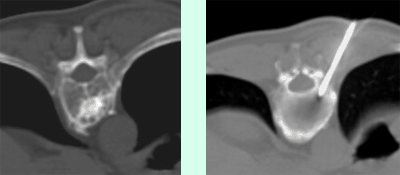
Stv. Abteilungsleiter: ltd. OA Assoc.-Prof. Priv.-Doz. Dr. Florian Wolf
Vaskuläre Intervention
Programmdirektorin: ltd. OÄ.in Prof.in Dr.in Maria Schoder
Aortentherapie
Programmdirektor: ltd. OA Prof. Dr. Martin Funovics
Vaskuläre Malformationen
Programmdirektor: ltd. OA Assoc.-Prof. Priv.-Doz. Dr. Florian Wolf
Onkologische Intervention
Programmdirektor: ltd. OA Dr. Fredrik Waneck
Cardiovaskuläre Magnetresonanz
Programmdirektor: ltd. OA Priv.-Doz. Dr. Dietrich Beitzke
Neurointervention
Programmdirektoren: PHD Dr. Patrick Thurner, Dr. Daniel Toth
Cardiovaskuläre Computertomographie
Programmdirektor: OA Prof. Dr. Stefan Puchner
Interventionelle Computertomographie
Programmdirektor: OA Dr. Lukas Reider
Transarterielle Periartikuläre Embolisationstherapie
Programmdirektor: OA Dr. Raoul Varga
Risikomanager: OA Dr. Christian Kinstner
Simulationstraining: Dr.in Alice Wielandner, Dr. Lukas Reider, Dr. Daniel Toth
Strahlenschutzbeauftragter: OA Prof. Dr. Stefan Puchner
Aortenaneurysma
Ein Aortenaneurysma ist eine umschriebene Erweiterung der Hauptschlagader (Aorta) entweder im Brustbereich (thorakales Aneurysma) oder im Bauch (abdominelles Aneurysma). Am häufigsten betroffen ist die Aorta unterhalb des Abganges der Nierenarterien (infrarenales Aneurysma) mit oder ohne Beteiligung der Beckenarterien.
Die Ursache eines Aortenaneurysmas ist meist eine schwere Atherosklerose (Arterienverkalkung) welche durch multifaktorielle Prozesse bedingt ist. Chronisch entzündliche Veränderungen führen zur Zerstörung von Bindegewebsfasern und glatten Muskelzellen und infolgedessen zur Schwächung der Gefäßwand. Als Risikofaktoren für die Entstehung von arteriosklerotischen Gefäßveränderungen gelten Nikotinabusus, Hypertonie, Hyperlipidämie und Übergewicht, aber auch das Alter, das männliche Geschlecht und eine familiäre Veranlagung.
Häufigkeit der Aneurysmen nach Verteilung
Abdominelle Aorta 55%
Thorakale Aorta 25%
Beckengefäße 3%
Andere Arterien 27%
Abdominelles Aortenaneurysma
Bei abdominellen Aneurysmen zu in 90% die infrarenale Aorta betroffen, und bei 10% bis 30% findet sich eine Mitbeteiligung der Beckenarterien.
Bei Männern besteht ab dem 55. Lebensjahr eine deutliche Steigerung der Inzidenz mit einer maximalen Häufigkeit von 5,9% im 80. Lebensjahr. Bei Frauen steigt die Inzidenz ab dem 70. Lebensjahr rapid an und erreicht ein Maximum von 4,5% im Alter von 90 Jahren. Insgesamt findet sich bei 5,4–6,6% der über 60-Jährigen ein Aneurysma.
Ein abdominelles Aneurysma liegt vor, wenn der infrarenale Aortendurchmesser mehr als 3 cm beträgt. Durchschnittlich wachsen Aneurysmen 2 mm pro Jahr. Die Wachstumstendenz kann jedoch nicht vorhergesagt werden und in 15–20% bleiben die Aneurysmen auch stabil, allerdings kann es auch nach Jahren zu einer plötzlichen Wachstumstendenz kommen, weswegen eine regelmäßige Kontrolle erforderlich ist. Die Größe eines Aneurysmas beeinflusst die Rupturgefahr. Das jährliche Rupturrisiko beträgt für Aneurysmen < 4 cm 2%, steigt jedoch bei Aneurysmen zwischen 6–7 cm bereits auf 10%.
Ein Aneurysma verursacht meist keine Symptome und wird oft im Rahmen einer Routineuntersuchung oder einer Röntgen- oder Ultraschalluntersuchung des Abdomens entdeckt. Ein Größenwachstum kann zu Druckschmerzhaftigkeit im Bauch, der Lendenwirbelsäule oder im Brustkorb führen. Diese symptomatischen Aneurysmen müssen einer raschen Therapie zugeführt werden. Viel häufiger treten allerdings akute Rupturen ohne Vorwarnung auf und führen oft zu lebensbedrohlichen Blutungen. Indikationen für eine Aneurysmatherapie sind neben Schmerzsymptomen eine Aneurysmagröße von 5 cm oder bei kleineren Aneurysmen ein jährliches Aneurysmawachstum von 0,5 cm und mehr.
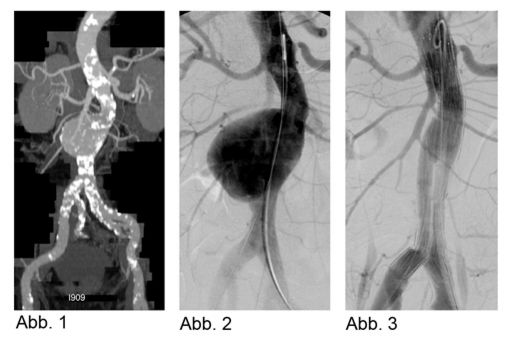
Die Abdomensonographie ist als Screeninguntersuchung und für eine routinemäßige Verlaufskontrolle bei Aneurysmen gut geeignet. Zur exakten Bestimmung der Größe und Morphologie wird jedoch eine Computertomographie (Abb. 1), in Ausnahmefällen eine Magnetresonanztomographie, durchgeführt.
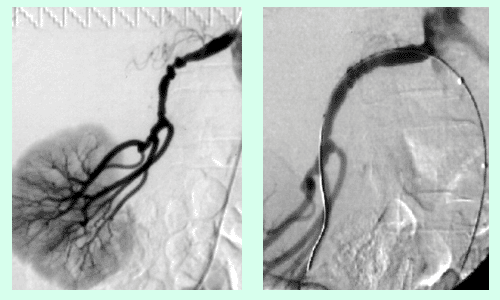
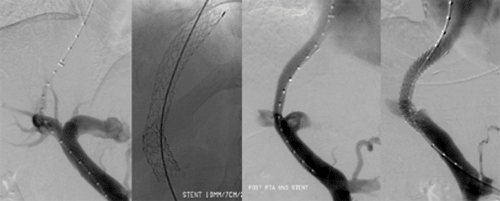
Alternativ zur offenen chirurgischen Therapie eines Aortenaneurysmas besteht die Möglichkeit einer endovaskulären Aneurysmaausschaltung mittels eines Stentgrafts (gewebeummanteltes Metallgittergeflecht). Voraussetzung für die endovaskuläre Therapie ist jedoch eine anatomische Eignung, welche eine ausreichende Weite der Beckengefäße und nötige Verankerungszonen für den Stentgraft mit sich bringt. Die Stentgraft Implantation wird von Interventionellen Radiologen in Zusammenarbeit mit Anästhesist:innen und Gefäßchirurg:innen durchgeführt. Der Eingriff erfolgt unter Spinalanästhesie oder einer Allgemeinnarkose. Der Zugang zum Aneurysma wird üblicherweise durch einen kurzen Schnitt in der Leiste geschaffen. Zur Darstellung des Aneurysmas wird zuerst eine Angiographie der Bauchaorta durchgeführt (Abb.2). Folglich wird unter Röntgendurchleuchtung der Stentgraft über einen Führungsdraht in die Bauchaorta eingebracht und unterhalb der Nierenarterien verankert. Eine Kontrollangiographie nach Stentgraft-Implantation wird zum Nachweis eines guten Ausschlusses des Aneurysmas durchgeführt (Abb.3).
Thorakales Aortenaneurysma
Die Inzidenz liegt bei 6/100000 Einwohner:innen/Jahr. Bei etwa 50% ist die Aorta ascendens, bei 10–15% der Aortenbogen und bei 35–45% die Aorta descendens betroffen. Bei 25% der Patient:innen mit atherosklerotischen thorakalen Aneurysmen besteht auch ein abdominelles Aortenaneurysma. Neben arteriosklerotischen Ursachen ist die chronische Aortendissektion als zweithäufigste Entität für eine pathologische Erweiterung der Aorta verantwortlich.
Eine Behandlungsindikation wird bei asymptomatischen Aneurysmen ab 6 cm Durchmesser gestellt. Bei entsprechender anatomischer Lage können große Aneurysmen zu Schluckbeschwerden oder Heiserkeit durch Kompression des Nervus laryngeus recurrens führen.
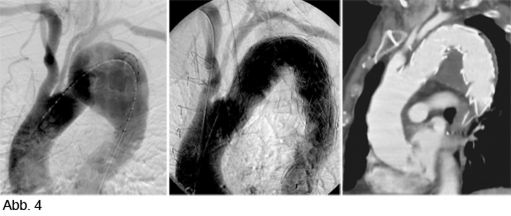
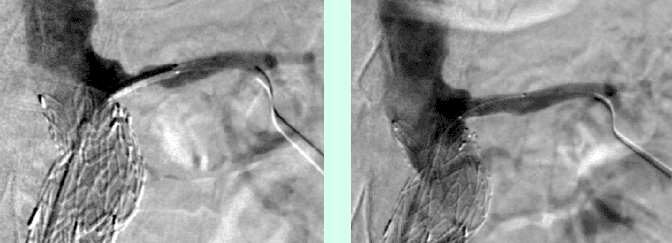
Bei elektiver chirurgischer Sanierung von Descendensaneurysmen wird die 30-Tages-Mortalität mit 5–13% angegeben. Weitere postoperative Komplikationen sind respiratorische Probleme, bis zu 33% neurologische Defizite und renale Insuffizienz bis zu 8%. Die endovaskuläre Stentgraft-Therapie hat deutlich geringere Mortalitäts- und Komplikationsraten und hat als Alternativmethode eine große Bedeutung in der Behandlung von Aneurysmen in der Aorta descendens und des Aortenbogens erlangt. Bei Beteiligung des Aortenbogens sind vorausgehende chirurgische Umbauten von Aortenbogenästen erforderlich, um eine Stentgraft Verankerung zu ermöglichen. Abbildung 4a zeigt ein Aneurysma mit Beteiligung des Aortenbogens und Abgang der linken Halsschlagader (Arteria carotis) und der linken armversorgenden Arterie (Arteria subclavia) in Nahebeziehung zum Aneurysma. Eine Stentgraft-Therapie kann in solchen Fällen nach Verlagerung (Transposition) der Arteria carotis und Arteria subclavia durchgeführt werden (Abb. 4). Die CT-Kontrolle bestätigt die korrekte Lage des Stent-grafts und den Ausschluss des Aneurysmas.
Therapie-Kontrolle
Die routinemäßige Verlaufsbeobachtung nach Stentgraft-Therapie wird mittels CT Angiographie einige Tage nach dem Eingriff und in weiterer Folge bei unkompliziertem postoperativem Verlauf jährlich durchgeführt.
Herz-CT
War die Darstellung der Koronararterien bis zur Jahrtausendwende im Wesentlichen der invasiven intraarteriellen Katheterangiographie vorbehalten, so brachten die technischen Entwicklungen der Computertomographie (CT) in den letzten wenigen Jahren die Möglichkeit, die Koronararterien auch nicht-invasiv mittels kontrastverstärkter CT-Angiographie (CTA) darzustellen. Aufgrund der spezifischen Besonderheiten der Koronarien wie geringer Durchmesser, gewundener Verlauf und vor allem der Bewegung während des Herzzyklus ist die Untersuchung der Koronarien jedoch nach wie vor nicht ganz unproblematisch. Eine genaue Indikationsstellung, welche mit dem zuweisenden Kollegen im Zweifelsfall diskutiert werden sollte, ist daher unerlässlich.
Im Folgenden sollen nun kurz technische Überlegungen, wesentliche Indikationen sowie Limitationen und Risken beschrieben werden.
Technik
Technische Voraussetzungen
Sowohl die räumliche als auch die zeitliche Auflösung wurde durch die Verfügbarkeit der Multislice-CT Geräte entscheidend verbessert. Mit dem an unserer Abteilung zur Verfügung stehenden CT-Scanner der 3. Generation können maximale räumliche und zeitliche Auflösungen erzielt werden. Bei diesen CT-Geräten der 3. Generation rotieren nicht eine Strahlenquelle und ein Detektor um Patient:innen, sondern 64 Detektoren. Das heißt, in einer Rotation wird nicht eine Schicht akquiriert, sondern es werden 64 Schichten gleichzeitig gemessen.
Um die zeitliche Auflösung weiter zu verbessern, ist es entscheidend, dass die Herzfrequenz der Patient:innen während der Untersuchung im Bereich von maximal 65 Schlägen pro Minute liegt. Es kann daher notwendig sein, dass direkt vor der Untersuchung ein beta-Blocker (z.B. Beloc) verabreicht wird, um die Herzfrequenz zu senken.
Durchführung der Untersuchung
Die Untersuchung wird in Rückenlage durchgeführt. Ein EKG wird angelegt, und ein venöser Zugang wird gelegt. Die Untersuchung erfolgt immer in Atemanhaltemanöver.
Ca-Scoring
Hier wird ein Scan mit minimaler Strahlenexposition ohne Kontrastmittel mit standardisierten Untersuchungsparametern durchgeführt. Aufgrund der Dichte der Verkalkungen wird der Kalkgehalt der Coaonarien nun gescort (Agatston-Score) und in 4 Kategorien eingeteilt (0–10; 10–100; 100–400; > 400).
CTA
Nach Anfertigen des Ca-Scorings wird die eigentliche CT-Angiographie der Koronarien während der raschen Injektion von ca. 90 ml nicht-ionischem Kontrastmittel durchgeführt. Es handelt sich hierbei um eine relativ strahlenintensive Untersuchung (6–10 mSv), weshalb die Indikation sehr genau gestellt werden sollte (siehe unten). Mit der neuesten Gerätegeneration ist es möglich, eine Herz-CTA mit noch deutlich geringerer Strahlenbelastung durchzuführen (ab etwa 1mSv).
EKG-Triggerung
Die Untersuchungen werden EKG-getriggert durchgeführt, um die Pulsationsbewegung durch die Herzaktion auszuschalten. Daher ist ein möglichst langsamer und regelmäßiger Rhythmus entscheidend. Mittels beta-Blocker-Gabe wird versucht, die Herzfrequenz zu reduzieren. Bei Vorliegen einer Arrhythmie kann es jedoch zu deutlichen Qualitätseinbußen kommen.
Derzeit an unserer Abteilung vor allem abgeklärte Fragestellungen:
KHK-Nachweis/Ausschluss
Die derzeit am besten gesicherte und auch sinnvollste Indikation für eine CT-Angiographie der Koronarien ist der KHK Ausschluss. Bei eindeutigen Zeichen einer akuten Ischämie (akutes Koronarsyndrom) ist unverzüglich eine invasive Abklärung mit Interventionsmöglichkeit anzustreben und nicht Zeit mit einer CT-Angiographie zu verlieren. Vielmehr liegt die Stärke der nicht-invasiven CT-Angiographie im Ausschluss (beziehungsweise im Nachweis) einer KHK bei Patient:innen mit eher geringer Vortestwahrscheinlichkeit; also Patient:innen, welche keine oder nur wenige Risikofaktoren aufweisen, bei welchen aber aufgrund unklarer Beschwerden (atypischer Thoraxschmerz) kurz- bis mittelfristig eine KHK ausgeschlossen werden muss. So ein:e Patient:in profitiert maximal, wenn es gelingt, nicht-invasiv mittels CT-Angiographie diesen KHK-Ausschluss bzw. Nachweis zu führen.
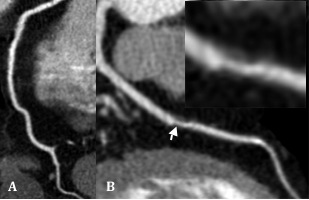
Während die RCA (A) völlig unauffällig zur Darstellung kommt, zeigt die LAD (B) im mittleren Drittel eine nicht-kalzifizierte Plaque (Pfeil und Insert).
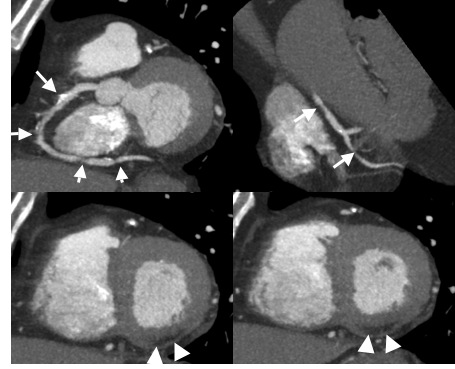
Abbildung: KHK-Nachweis mittels kontrastverstärkter CTA der Koronarien
72y, m, laut EKG St.p. nicht-rezentem MCI (Hinterwand)
Zuweisung zur CTA zum KHK-Nachweis bzw. zur Therapieplanung
Darstellung zahlreicher relevant stenosierender, teilweise verkalkter Läsionen im Verlauf der RCA (Pfeile). Passend zum EKG-Befund sowie zu den Läsionen im Verlauf der RCA ausgedehnte Narbe im Bereich der Hinterwand (Pfeilspitzen).
Verlaufskontrolle nach Bypassoperation
Patient:innen nach koronarer Bypassoperation waren im Prinzip die erste Patient:innengruppe, welche mittels CT-Angiographien der Koronarien untersucht wurden. Der extraanatomische Verlauf der Bypässe und ihre dadurch geringere Bewegungsartefaktanfälligkeit etablierten diese Indikation sehr bald in der Routine. Für diese Patient:innen ist die nicht-invasive CTA als Alternative zum Herzkatheter vor allem deswegen auch von besonderer Bedeutung, als dass die Darstellung der Bypässe mittels Herzkatheter mitunter erschwert sein kann (extraanatomischer Verlauf; multiple aortocoronare Bypässe; frustrane Sondierung aller Bypässe; LIMA/RIMA-Bypässe). Hier bringt die CT-Angiographie eine wesentliche Alternative.
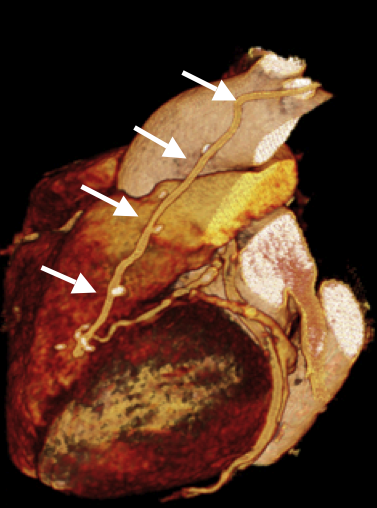
Die Abbildung zeigt eine CT Angiographie der Herzkranzarterien bei einer 77-jährigen Patientin, bei der ein Zustand nach Anlage eines LIMA-ad-LAD-Bypasses vor einem Jahr besteht. Die Patientin leidet unter neuerlichen Angina pectoris-Beschwerden.
Der Bypass ist regulär dargestellt (Pfeile), allerdings ist das Zielgefäß (distale LAD) nur sehr zart.
Verlaufskontrolle nach endovaskulärer Therapie
Heute erfolgt die endovaskuläre Therapie der Koronarien in den überwiegenden Fällen mittels Stentimplantation. Die metalldichten Stents haben im CT eine ähnliche Dichte, was die Beurteilbarkeit von Stents in der CTA beeinträchtigen kann. In Abhängigkeit von Stentlänge, Stentdurchmesser und Gefäßabschnitt, welcher gestentet wurde, kann eine Beurteilung des Stentlumens mittels CT-Angiographie erfolgen (Figur 7). Mittels neuer Rekonstruktions- und Bildbearbeitungsalgorithmen wird die Stentbeurteilbarkeit in den nächsten Jahren jedoch deutlich verbessert werden. Derzeit sind Patient:innen nach langstreckiger und multipler Stentimplantation keine idealen Patient:innen zur Herz-CT.
Weitere Indikationen:
- Verlaufskontrolle nach Herztransplantation als Alternative zur jährlichen konventionellen Herzkatheteruntersuchung
- Planung einer elektrophysiologischen Therapie (Ablation)
- KHK-Ausschluss vor großer Operation (für Freigabe)
- Patient:innen mit kongenitalen Vitien
- Patient:innen mit Koronararterienanomalien
Kontraindikationen und Limitationen
Für eine CT-Angiographie der Koronarien gelten dieselben absoluten und relativen Kontraindikationen wie für jede Computertomographie mit iodhältigem, intravenös verabreichtem Kontrastmittel. Die wesentlichen Kontraindikationen und die adäquaten Vorbereitungsmaßnahmen sind in Tabelle 1 kurz zusammengefasst. Um eine etwaige Kontraindikation gegen die Kontrastmittelgabe festzustellen, wird Patient:innen ein standartisierter Fragebogen vor der Untersuchung übergeben. Dieser Fragebogen bzw. dieses Aufklärungsblatt sind hier online abrufbar.
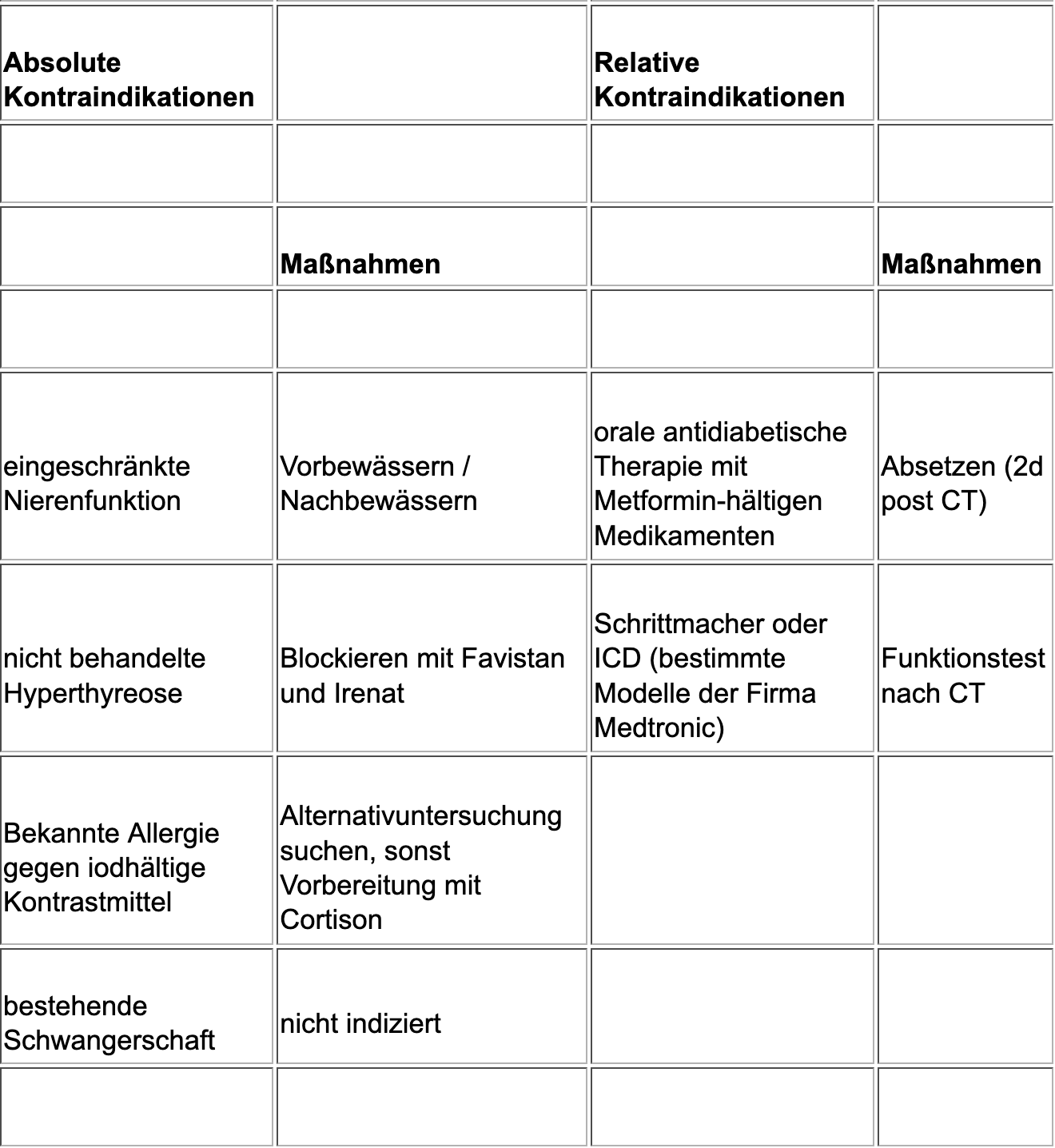
Tabelle 1
Allgemeine absolute und relative Kontraindikationen gegen eine kontrastverstärkte CT
Darüberhinaus gibt es für die CT-Angiographie der Koronarien noch spezielle Kontraindikationen und Limitationen (Tabelle 2).
Bei einem Agatston-Score (siehe Ca-Scoring) von mehr als 500 ist die Beurteilbarkeit der CT-Angiographie der Koronarien massiv durch die Aufhärtungsartefakte des Kalks beeinträchtigt. Eine suffiziente Beurteilung der Signifikanz der Verkalkungen ist in diesen Fällen nicht möglich.
Aufgrund der oben erwähnten überragenden Bedeutung der EKG-Triggerung für die Untersuchungsqualität ist wegen der zu erwartenden Pulsationsartefakte bei Vorliegen einer Tachyarhythmie ebenfalls von der Durchführung der CT-Angiographie Abstand zu nehmen.
Zusammenfassung
Die Möglichkeiten moderner Multislice-CT-Scanner mit ihrer enorm verbesserten räumlichen und zeitlichen Auflösung erlauben bei einem Großteil der Patient:innen die exakte nicht-invasive Darstellung der Koronarien. Insbesondere zum Ausschluss einer KHK und zur Therapiekontrolle nach Bypassoperation eignet sich die CTA und findet dementsprechend rasch zunehmende Anwendung. Aufgrund noch bestehender Limitationen und Risken ist eine genaue und restriktive Patient:innenselektion und Patient:innenvorbereitung unerlässlich. Mit weiteren technischen Innovationen innerhalb der nächsten Jahre werden jedoch die vor allem im Bereich der Herzfrequenz, liegenden derzeit noch bestehenden Limitationen minimiert werden können. An unserer Abteilung ist ab 2010 ein Scanner der neuesten Generation (Siemens Somatom Definition Flash) im Einsatz, welcher es erlaubt, mit einer deutlich niedrigeren Strahlenbelastung eine Herz-CTA durchzuführen. Die Qualität der Untersuchung wird auch bei Patient:inneen mit einer höheren Herzfrequenz deutlich verbessert werden. Außerdem können in Zukunft auch Patient:innen untersucht werden, welche den Atem nur schlecht oder gar nicht anhalten können.
FAQ:
Kann ich mir mit einer CT Angiographie der Koronarien einen Herzkatheter ersparen?
Mit einer CT Angiographie der Koronarien kann lediglich ein Ausschluß oder ein Nachweis einer koronaren Herzkrankheit (KHK) erfolgen – für eine Therapie ist dann aber doch in vielen Fällen ein Herzkatheter (mit Stentimplantation) notwendig. Das heißt, wenn eine sehr hohe Wahrscheinlichkeit besteht, dass Sie eine behandlungswürdige KHK haben (eindeutige Schmerzen, positive Ergometrie (Fahrradtest), positive Szintigraphie), kann Ihnen die CT den Herzkatheter wahrscheinlich nicht ersparen. Die Zuweisung zur CT der Koronarien sollte daher immer von ihrem:ihrer behandelnden Ärzt:in erfolgen. Diese:r kann am besten einschätzen, ob die CT der Koronarien zusätzliche Information bringt oder aber nur eine zusätzliche Untersuchung vor dem Herzkatheter ist.
Wann ist eine CT Angiographie der Koronarien indiziert (sinnvoll)?
- bei klinischen Beschwerden, aber eher geringer Wahrscheinlichkeit einer KHK (Ausschluss)
- bei bekannter KHK zur Therapieplanung
- bei Verdacht auf KHK und Vorbehalten gegen einen Herzkatheter
- als Kontrolle nach Bypass-Operation
- als Kontrolle nach Herztransplantation
- als Vorbereitung vor geplanter elektrophysiologischer Behandlung
Gibt es spezielle Kontraindikationen gegen eine CT der Koronarien?
Vom Prinzip her ist die CT-Angiographie der Koronarien für Patient:innen nicht anders als eine CT mit Kontrastmittel. Es gelten daher prinzipiell dieselben Kontraindikationen wie für jede Kontrastmittelgabe (siehe oben, siehe auch Aufklärungsblätter Homepage der Österreichischen Röntgengesellschaft www.oerg.at); also eine bekannte KM-Allergie, Niereninsuffizienz, Schilddrüsenüberfunktion. Darüber hinaus gibt es für die CT Angiographie der Koronarien nur einige besondere zusätzliche Einschränkungen: tachykardes Vorhofflimmern und hochgradige Verkalkungen der Koronarien (welche man erst nach dem ersten Teil der CT der Koronarien, dem Ca-Scoring, feststellen kann).
Sollte man eine CT Angiographie der Koronarien als Screening-Test durchführen (einmal im Jahr?)?
Nein. Die Methode ist derzeit nicht als Screening-Test geeignet. Eine CT-Angiographie der Koronarien sollte nur dann durchgeführt werden, wenn ihr:e betreuende:r Ärzt:in das für sinnvoll und notwendig erachtet.
Braucht man eine spezielle Vorbereitung zur CT der Koronarien?
Nein. Wie bei jeder CT mit Kontrastmittelgabe sollte man 4 Stunden nüchtern sein.
Wie lange dauert eine CT der Koronarien?
Inklusive Vorbereitung (EKG-Anlage) dauert die Untersuchung maximal 15 Minuten.
CT-Angiographie
Durch die enormen technischen Weiterentwicklungen der CT-Technik in den letzten 10 Jahren können mittels CT nunmehr alle Gefäßgebiete in sehr hoher räumlicher Auflösung dargestellt werden. Dabei wird gleichzeitig zur CT-Untersuchung Kontrastmittel intravenös verabreicht, um die Arterien darzustellen. Durch die hohe Untersuchungsgeschwindigkeit können auch große Gefäßsysteme (die gesamte Körperschlagader, die kompletten Beinarterien) in einer Untersuchung dargestellt werden. Somit können die meisten Veränderungen der Arterien nicht-invasiv dargestellt werden. Das heißt, eine direkte Punktion der Arterie (so wie in der Angiographie, siehe dort) ist nicht notwendig.
Die Untersuchungstechnik ist im Prinzip für alle Gefäßgebiete dieselbe (zumindest für Patient:innen ergibt sich kein merkbarer Unterschied), es werden lediglich geringe Adaptierungen in der Kontrastmittelgabe bzw. in der Bildakquisition an das zu untersuchende Gefäßterritorium vorgenommen.
Technik
Technische Voraussetzungen
Sowohl die räumliche als auch die zeitliche Auflösung wurde durch die Verfügbarkeit der Multislice-CT Geräte entscheidend verbessert. Mit dem an unserer Abteilung zur Verfügung stehenden CT-Scanner der 3. Generation können maximale räumliche und zeitliche Auflösungen erzielt werden. Bei diesen CT-Geräten der 3. Generation rotieren nicht eine Strahlenquelle und ein Detektor um den Patienten, sondern 64 Detektoren. Das heißt, in einer Rotation wird nicht eine Schicht akquiriert, sondern es werden 64 Schichten gleichzeitig gemessen.
Durchführung der Untersuchung
Die Untersuchung wird in Rückenlage durchgeführt. Gegebenenfalls wird ein EKG angelegt. Routinemäßig wird ein venöser Zugang gelegt, über welchen dann das Kontrastmittel verabreicht wird. Die Untersuchung erfolgt immer im Atemanhaltemanöver.
Die CT-Angiographie erfolgt während der raschen Injektion von ca. 90–110 ml nicht-ionischem Kontrastmittel.
EKG-Triggerung
Die Untersuchungen der Brustschlagader werden EKG-getriggert durchgeführt (siehe unten), um die Pulsationsbewegung durch die Herzaktion auszuschalten.
Im Folgenden sollen nun kurz technische Überlegungen, wesentliche Indikationen sowie Limitationen und Risken beschrieben werden.
Derzeit an unserer Abteilung vor allem untersuchte Gefäßregionen:
Aorta (Körperschlagader)
Hauptfragestellung bei der Durchführung einer CT-Angiographie der Aorta (sei es jetzt im Brust-oder im Bauchbereich) ist die Abklärung einer krankhaften Erweiterung der Aorta (ein so genanntes Aortenaneurysma). Die Notwendigkeit, so ein Aneurysma zu behandeln, wird maßgeblich vom Durchmesser der Erweiterung beeinflusst. So stellt ein Durchmesser eines Aortenaneurysmas von mehr als 6 cm im Brustbereich bzw. von mehr als 5–5,5cm im Bauchbereich eine Indikation zur Behandlung dar. Die Untersuchungen der Brustschlagader werden EKG-getriggert durchgeführt (siehe unten), um die Pulsationsbewegung durch die Herzaktion auszuschalten.
Die CT-Angiographie ist (mit der MR-Angiographie, siehe dort) nicht nur die exakteste Methode, um den Durchmesser eines Aortenaneurysmas zu messen, sondern auch die optimale Basis, um eine Therapieentscheidung zu treffen. Alle Parameter, die notwendig sind, um zu entscheiden, ob eine endovaskuläre Behandlung (Stentgraftimplantation, siehe dort) möglich ist, können mittels CT-Angiographie ermittelt werden.
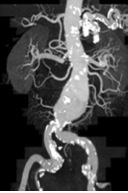
Abbildung:
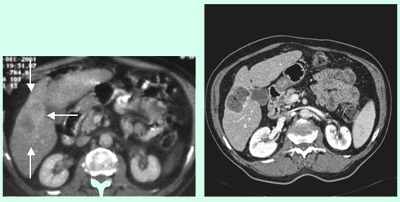
Die Abbildung zeigt eine CT Angiographie der abdominellen Aorta bei einem 85-jährigen Patienten. Die CTA zeigt ein Aneurysma der Aorta. Aufgrund des geringen Abstandes vom Beginn des Aneurysmas zu den akzessorischen Nierenarterien ist eine Behandlung des Aneurysmas mittels Stentgraftimplantation nicht möglich.
Weitere häufige Fragestellungen, welche zur Zuweisung zu einer CT Angiographie der Aorta führen, sind
- Verlaufskontrolle nach Therapie eines Aortenaneurysmas,
- Abklärung oder Verlaufskontrolle einer Aortendissektion
- Suche einer Emboliequelle
Nierenarterien (Arteriae renales)
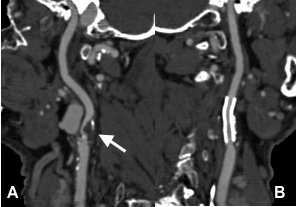
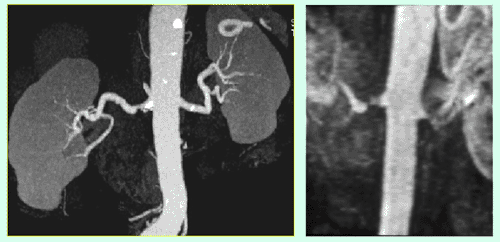
Hauptfragestellung bei der Durchführung einer CT Angiographie der Nierenarterien ist die Abklärung eines Bluthochdrucks, welcher durch eine Engstellung der Nierenarterie(n) (eine so genannte Nierenarterienstenose) verursacht werden kann.
Die CT Angiographie ist (so wie die MR Angiographie, siehe dort) eine optimale Methode, um nicht-invasiv das Vorliegen einer Nierenarterienstenose nachzuweisen bzw. auszuschließen (siehe Abbildung). Die Planung einer Ballondilatation mit Stentimplantation (PTA und Stent, siehe dort) im Falle des Vorliegens einer Nierenarterienstenose kann anhand der CT Angiographie erfolgen. Ebenso kann die Verlaufskontrolle nach erfolgter Stentimplantation nicht-invasiv mittels CT Angiographie erfolgen (Goldstandard).
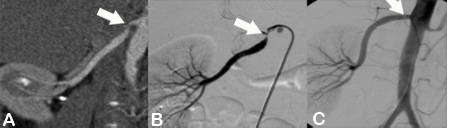
Abbildung:
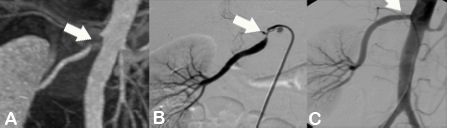
Abbildung A zeigt eine CT Angiographie der rechten Nierenarterie bei einer jungen Patientin mit schlecht einstellbarem Bluthochdruck. Die CTA zeigt deutlich eine hochgradige Abgangsstenose der rechten Nierenarterie (Pfeil). Anhand dieser CT Angiographie wurde die Entscheidung zur PTA und Stentimplantation getroffen, und die Behandlung wurde geplant.
Abbildung B zeigt die Angiographie unmittelbar vor der Stentimplantation, welche den CT-Befund bestätigt (Pfeil).
Abbildung C zeigt die Kontrollangiographie nach Stentimplantation (Pfeil) mit hervorragendem Ergebnis.
Halsschlagader (Arteria carotis)
Hauptfragestellung bei der Durchführung einer CT Angiographie der A. carotis ist die Frage nach einer relevanten Stenose der A. carotis interna (innere Halsschlagader, welche das Gehirn versorgt) oder der A. vertebralis. Die Methode der Wahl für diese Fragestellung ist der Duplexultraschall, wo die Relevanz einer Stenose direkt quantifiziert werden kann. Bei manchen Patient:innen kann aufgrund der anatomischen Gegebenheiten oder vorhandener Verkalkungen dieser Duplexultraschall eingeschränkt beurteilbar sein. In solchen Fällen ist die CT Angiographie (so wie die MR Angiographie, siehe dort) der A. carotis eine sehr gute und sichere Alternative.
Die CT Angiographie ist (so wie die MR Angiographie, siehe dort) eine optimale Methode, um nicht-invasiv das Vorliegen einer relevanten Carotisstenose nachzuweisen bzw. auszuschließen. Die Planung einer Ballondilatation mit Stentimplantation (PTA und Stent, siehe dort) im Falle des Vorliegens einer Carotisstenose kann optimal anhand der CT Angiographie erfolgen. Ebenso kann die Verlaufskontrolle nach erfolgter Stentimplantation nicht-invasiv mittels CT Angiographie erfolgen.
Abbildung:
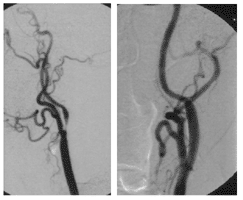
Die Abbildungen A und B zeigen einen 67-jährigen Mann nach Stentimplantation in die linke Arteria carotis interna vor 2 Jahren.
Abb. B zeigt die CT Angiographie des Stents in der linken ACI, welcher regulär entfaltet und perfundiert ist.
Abb. A zeigt jedoch eine höchstgradige Stenose der ACI auf der rechten Seite (Pfeil).
Becken-Bein-Arterien
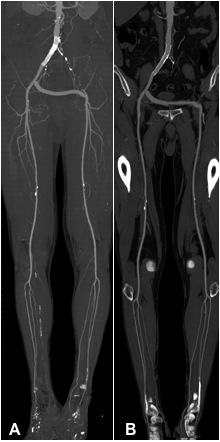
Hauptfragestellung bei der Durchführung einer CT Angiographie der Becken-Bein-Arterien ist die Abklärung einer Schaufensterkrankheit. Die CT Angiographie ist (so wie die MR Angiographie, siehe dort) eine optimale Methode, um nicht-invasiv das Vorliegen behandlungswürdiger Engstellen in den Becken- und Beinarterien nachzuweisen bzw. auszuschließen. Anhand der CT-Bilder kann die Entscheidung, ob eine chirurgische (z.B. Bypass) oder eine endovaskuläre (Ballondilatation mit oder ohne Stentimplantation (PTA und Stent, siehe dort)) Therapie vorzuziehen ist, erfolgen. Ebenso kann die Verlaufskontrolle nach erfolgter Stentimplantation oder Bypassoperation nicht-invasiv mittels CT Angiographie erfolgen.
Abbildung:
Die Abbildungen A und B zeigen einen 74-jährigen Mann nach Stentimplantation in die rechte Beckenarterie sowie Anlage eines cross-over-Bypass von rechts nach links bei Verschluss der linken Beckenarterien.
Abb. A zeigt eine MIP-Darstellung der CT Angiographie der Becken-Bein-Arterien. Bei guter Übersichtlichkeit ist der Stent in der rechten Beckenarterie nicht zu beurteilen.
In der nur an unserer Abteilung verfügbaren MultiPath-CPR (Abb. B) kann in den Stent hineingeschaut werden. So kann man beurteilen, ob eine Instent-Restenose vorliegt.
Weitere Untersuchungsregionen, welche mittels CT Angiographie untersucht werden:
- Viszeralarterien
- A. subclavia
- Transplantatarterien
Kontraindikationen und Limitationen
Für eine CT-Angiographie gelten dieselben absoluten und relativen Kontraindikationen wie für jede Computertomographie mit iodhältigem, intravenös verabreichtem Kontrastmittel. Die wesentlichen Kontraindikationen und die adäquaten Vorbereitungsmaßnahmen sind in Tabelle 1 kurz zusammengefasst. Um eine etwaige Kontraindikation gegen die Kontrastmittelgabe festzustellen, wird Patient:innen ein standardisierter Fragebogen vor der Untersuchung ausgeteilt. Diese Fragebögen bzw. Aufklärungsblätter sind online abrufbar (www.oerg.at).
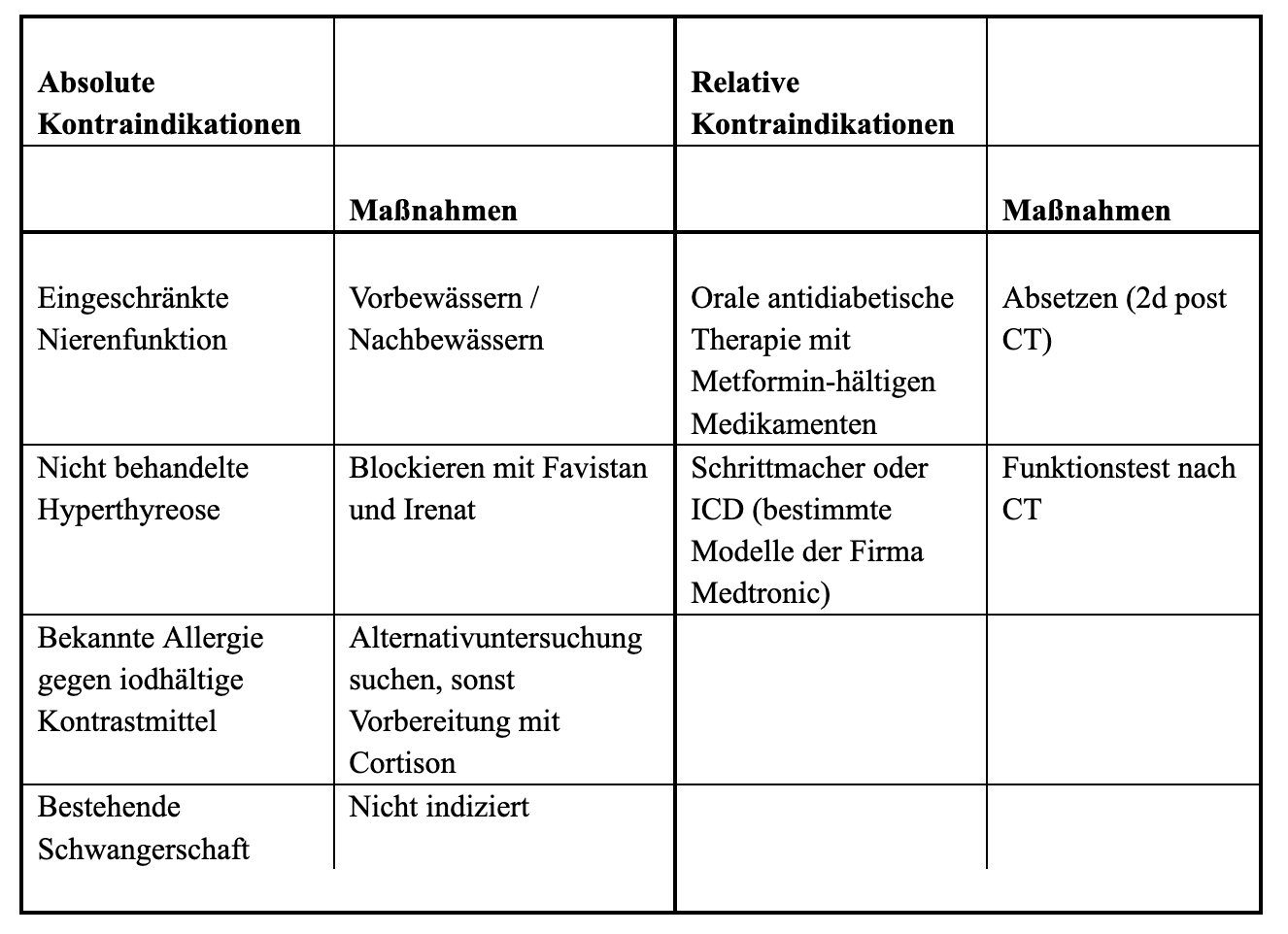
Tabelle 1
Allgemeine absolute und relative Kontraindikationen gegen eine kontrastverstärkte CT
FAQ:
Kann ich mir mit einer CT Angiographie eine Angiographie mit arterieller Punktion ersparen?
Viele Erkrankungen der Arterien führen nicht unmittelbar zu einer Behandlung. Andere Erkrankungen der Arterien sind in Wirklichkeit viel seltener als klinisch vermutet. So haben nur etwa 5 von 100 Patient:innen mit Bluthochdruck wirklich eine Nierenarterienstenose. In diesen Fällen kann mittels nicht-invasiver CT Angiographie sehr wohl eine invasive Angiographie mit Punktion der Leistenarterie erspart werden.
In anderen Fällen wird nach der CT Angiographie sehr wohl noch eine invasive Angiographie zur Behandlung (PTA, Stent, siehe dort) notwendig sein, in diesen Fällen kann die Behandlung anhand der CT Angiographie optimal geplant werden.
Die Durchführung einer CT Angiographie vor (oder anstatt) einer geplanten Angiographie ist daher in sehr vielen Fällen sinnvoll und indiziert.
Wann ist eine CT Angiographie sinnvoll?
Nahezu sämtliche arterielle Erkrankungen können mittels CT Angiographie nachgewiesen bzw. ausgeschlossen werden. Die folgende Liste gibt nur einen kurzen Überblick über einzelne, besonders häufig abgeklärte Fragestellungen:
- Verdacht oder bekanntes Aortenaneurysma
- Verdacht auf Nierenarterienstenose
- bei Verdacht auf Carotisstenose
- Schaufensterkrankheit
- Angina abdominalis
- Kontrolle nach allen endovaskulären oder chirurgischen Eingriffen an den Arterien (Bypass, Ballondehnung, PTA etc.)
Gibt es spezielle Kontraindikationen gegen eine CT Angiographie?
Vom Prinzip her ist die CT Angiographie für Patient:innen nicht anders als eine CT mit Kontrastmittel. Es gelten daher prinzipiell dieselben Kontraindikationen wie für jede Kontrastmittelgabe (siehe oben, siehe auch Aufklärungsblätter Homepage der Österreichischen Röntgengesellschaft, www.oerg.at); also eine bekannte KM-Allergie, Niereninsuffizienz, Schilddrüsenüberfunktion.
Braucht man eine spezielle Vorbereitung zur CT Angiographie?
Nein. Wie bei jeder CT mit Kontrastmittelgabe sollte man 4 Stunden nüchtern sein.
Wie lange dauert eine CT Angiographie?
Inklusive Vorbereitung (EKG-Anlage, wenn notwendig) dauert die Untersuchung maximal 10 Minuten.
Wann soll eine CT Angiographie, wann eine MR Angiographie durchgeführt werden?
Zum einen ist hier das unterschiedliche Profil an Kontraindikationen entscheidend: Patient:innen mit Herzschrittmacher, implantierten Defibrillatoren, Insulinpumpen und dergleichen, Patient:innen mit Platzangst und Patient:innen nach Stentimplantation sind Patient:innen, die mittels CT Angiographie untersucht werden sollten. Patient:innen mit Niereninsuffizienz, Diabetiker:innen, Patient:innen mit Schilddrüsenüberfunktion oder Patient:innen mit Jodallergie sollten dagegen im MR untersucht werden.
Darüber hinaus kann die Fragestellung für die Entscheidung CT oder MR entscheidend sein. Fragestellungen der Aorta werden primär im CT untersucht, Becken-Bein-Arterien primär im MR. Die Entscheidung kann aber auch Fall für Fall individuell zu treffen sein.
MR-Angiographie
Durch die technischen Weiterentwicklungen der MR-Technik in den letzten 10 Jahren können auch Arterien mittels MR (kontrastverstärkte MR Angiographie) mit ausreichender räumlicher Auflösung dargestellt werden. Dabei wird gleichzeitig zur MR-Untersuchung Kontrastmittel intravenös verabreicht, um die Arterien darzustellen. Somit können die meisten Veränderungen der Arterien nicht-invasiv dargestellt werden. Das heißt, eine direkte Punktion der Arterie (so wie in der Angiographie, siehe dort) ist nicht notwendig.
Die Untersuchungstechnik ist im Prinzip für alle Gefäßgebiete dieselbe (zumindest für Patient:innen ergibt sich kein merkbarer Unterschied), es werden lediglich geringe Adaptierungen in der Kontrastmittelgabe bzw. in der Bildakquisition an das zu untersuchende Gefäßterritorium vorgenommen.
Technik
Technische Voraussetzungen
Sowohl die räumliche als auch die zeitliche Auflösung wurde durch die Verfügbarkeit der Hochfeld-MR-Geräte (1,5–3,0T) deutlich verbessert. Mit modernen Empfängerspulen konnte das Signal-Rausch-Verhältnis weiter verbessert werden.
Durchführung der Untersuchung
Die Untersuchung wird in Rückenlage durchgeführt.
Routinemäßig wird ein venöser Zugang gelegt, über welchen dann das Kontrastmittel verabreicht wird. Die Untersuchung erfolgt immer im Atemanhaltemanöver.
Die MR-Angiographie erfolgt während der raschen Injektion von ca. 15–30 ml eines Gadolinium-hältigen Kontrastmittels.
Derzeit an unserer Abteilung häufig untersuchte Gefäßregionen:
Aorta (Körperschlagader)
Hauptfragestellung bei der Durchführung einer MR Angiographie der Aorta (sei es jetzt im Brust- oder im Bauchbereich) ist die Abklärung einer krankhaften Erweiterung der Aorta (so genanntes Aortenaneurysma). Die Notwendigkeit, so ein Aneurysma zu behandeln, wird maßgeblich vom Durchmesser der Erweiterung beeinflusst. So stellt ein Durchmesser eines Aortenaneurysmas von mehr als 6 cm im Brustbereich bzw. von mehr als 5–5,5cm im Bauchbereich eine Indikation zur Behandlung dar.
Die MR Angiographie ist (mit der CT Angiographie, siehe dort) eine optimale Basis, um eine Therapieentscheidung zu treffen. Alle Parameter, die notwendig sind, um zu entscheiden, ob eine endovaskuläre Behandlung (Stentgraftimplantation, siehe dort), können mittels MR Angiographie ermittelt werden. Aufgrund der noch höheren Ortsauflösung ist für diese Fragestellung jedoch die CT Angiographie die Methode der Wahl. Die MR Angiographie bleibt in dieser Fragestellung Patient:innen mit Kontraindikationen gegen eine CT Angiographie vorbehalten.
Weitere häufige Fragestellungen, welche zur Zuweisung zu einer MR Angiographie der Aorta führen, sind
- Verlaufskontrolle nach Therapie eines Aortenaneurysmas,
- Abklärung oder Verlaufskontrolle einer Aortendissektion
- Suche einer Emboliequelle
Nierenarterien (Arteriae renales)
Hauptfragestellung bei der Durchführung einer MR Angiographie der Nierenarterien ist die Abklärung eines Bluthochdrucks, welcher durch eine Engstellung der Nierenarterie(n) (so genannte Nierenarterienstenose) verursacht werden kann.
Die MR Angiographie ist (so wie die CT Angiographie, siehe dort) eine optimale Methode, um nicht-invasiv das Vorliegen einer Nierenarterienstenose nachzuweisen bzw. auszuschließen. Die Planung einer Ballondilatation mit Stentimplantation (PTA und Stent, siehe dort) im Falle des Vorliegens einer Nierenarterienstenose kann anhand der MR Angiographie erfolgen. Die Verlaufskontrolle nach erfolgter Stentimplantation sollte nicht-invasiv mittels CT Angiographie erfolgen.
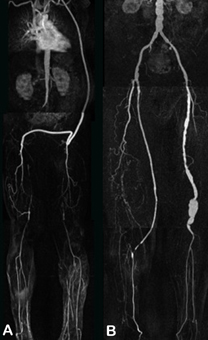
Abbildung:
Abbildung A zeigt eine MR Angiographie der Becken-Bein-Arterien bei Patient:innen mit Verschluss der Aorta infrarenalis sowie der Beckenarterien beidseits. Es besteht ein Zustand nach Anlage eines axillofemoralen Bypass sowie Anlage einer Links-Rechts-Umleitung. Auch die Oberschenkelarterien sind beidseits verschlossen.
Abbildung B zeigt eine MR Angiographie der Becken-Bein-Arterien bei einem Patient:innen mit Zustand nach Anlage eines femoropoplitealen Bypasses rechts. Darüberhinaus besteht ein Aneurysma der linken A. poplitea.
Weitere Untersuchungsregionen, welche mittels MR Angiographie untersucht werden:
- Viszeralarterien
- A. subclavia
- Transplantatarterien
- Arteriovenöse Malformationen
Kontraindikationen und Limitationen
Für eine MR-Angiographie gelten dieselben absoluten und relativen Kontraindikationen wie für jede Magnetresonanztomographie mit Gadolinium-hältigem intravenös verabreichtem Kontrastmittel. Die wesentlichen Kontraindikationen und die adäquaten Vorbereitungsmaßnahmen sind in Tabelle 1 kurz zusammengefasst. Um eine etwaige Kontraindikation gegen die Kontrastmittelgabe festzustellen, wird Patienet:innen ein standartisierter Fragebogen vor der Untersuchung ausgeteilt. Diese Fragebögen bzw. Aufklärungsblätter sind online abrufbar (www.oerg.at).
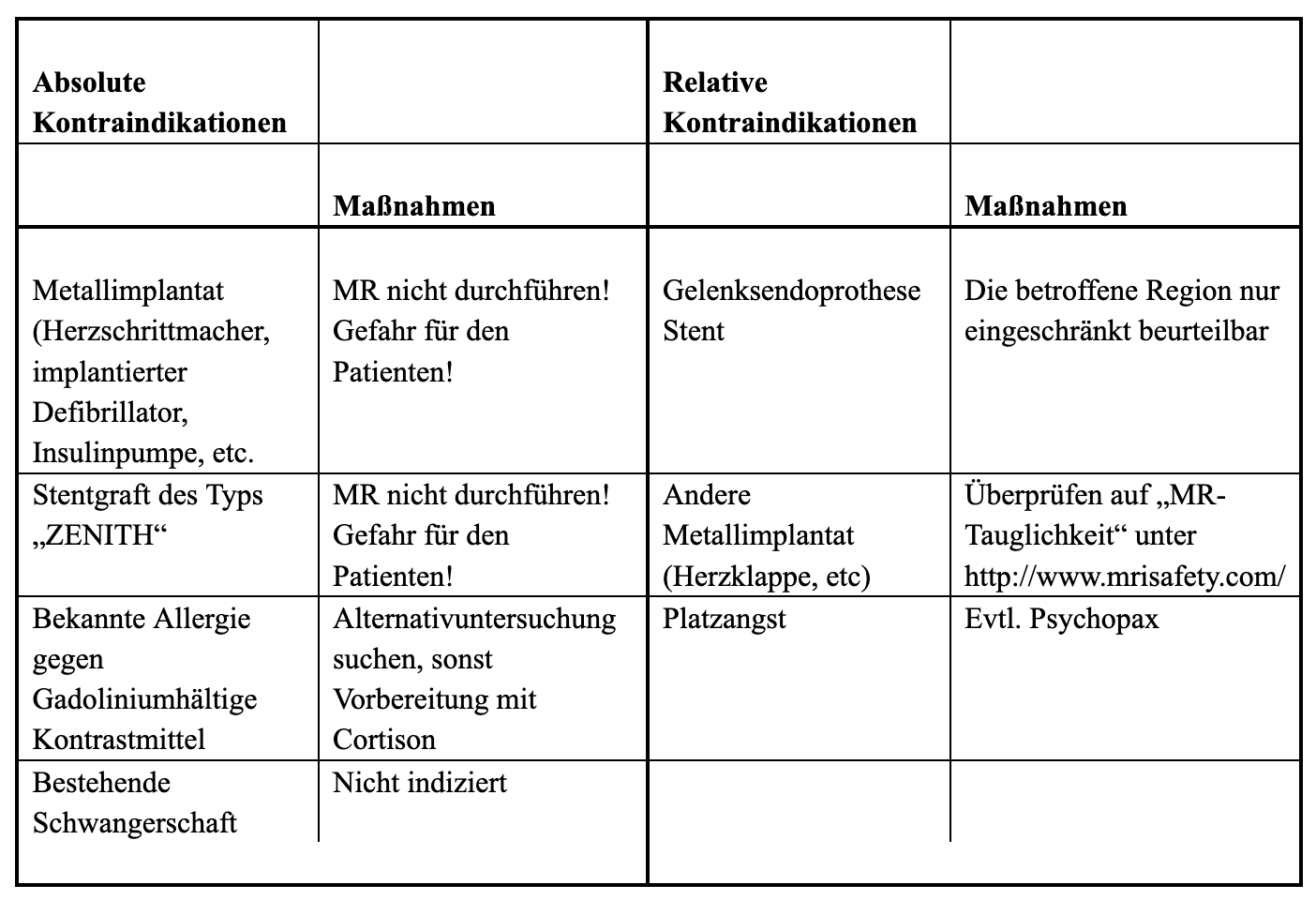
Tabelle 1
Allgemeine absolute und relative Kontraindikationen gegen eine kontrastverstärkte MR
FAQ:
Kann ich mir mit einer MR Angiographie eine Angiographie mit arterieller Punktion ersparen?
Viele Erkrankungen der Arterien führen nicht unmittelbar zu einer Behandlung. Andere Erkrankungen der Arterien sind in Wirklichkeit viel seltener als klinisch vermutet. So haben nur etwa 5 von 100 Patient:innen mit Bluthochdruck wirklich eine Nierenarterienstenose. In diesen Fällen kann mittels nicht-invasiver MR Angiographie sehr wohl eine invasive Angiographie mit Punktion der Leistenarterie erspart werden.
In anderen Fällen wird nach der MR Angiographie sehr wohl noch eine invasive Angiographie zur Behandlung (PTA, Stent, siehe dort) notwendig sein, in diesen Fällen kann die Behandlung anhand der MR Angiographie optimal geplant werden.
Die Durchführung einer MR Angiographie vor (oder anstatt) einer geplanten Angiographie ist daher in sehr vielen Fällen sinnvoll und indiziert.
Wann ist eine MR Angiographie sinnvoll?
Nahezu sämtliche arterielle Erkrankungen können mittels MR Angiographie nachgewiesen bzw. ausgeschlossen werden. Die folgende Liste gibt nur einen kurzen Überblick über einzelne, besonders häufig abgeklärte Fragestellungen:
- Verdacht oder bekanntes Aortenaneurysma
- Verdacht auf Nierenarterienstenose
- bei Verdacht auf Carotisstenose
- Schaufensterkrankheit
- Angina abdominalis
- Arterio-venöse Malformationen („Hämangiome“)
- Kontrolle nach verschiedenen Eingriffen an den Arterien (Bypass, Ballondehnung), mit Ausnahmen nach Stentimplantation.
Gibt es spezielle Kontraindikationen gegen eine MR Angiographie?
Vom Prinzip her ist die MR Angiographie für dPatient:innen nicht anders als eine MR mit Kontrastmittel. Es gelten daher prinzipiell dieselben Kontraindikationen wie für jede Kontrastmittelgabe (siehe oben, siehe auch Aufklärungsblätter Homepage der Österreichischen Röntgengesellschaft, www.oerg.at), alsolso eine bekannte KM-Allergie, Schrittmacherimplantation, etc.
Braucht man eine spezielle Vorbereitung zur MR Angiographie?
Nein. Auch muss man nicht nüchtern sein.
Wie lange dauert eine MR Angiographie?
Inklusive Vorbereitung dauert die Untersuchung maximal 30 Minuten.
Wann soll eine MR Angiographie, wann eine CT Angiographie durchgeführt werden?
Zum einen ist hier das unterschiedliche Profil an Kontraindikationen entscheidend: Patient:innen mit Herzschrittmacher, implantierten Defibrillatoren, Insulinpumpen und dergleichen, Patient:innen mit Platzangst und Patient:innen nach Stentimplantation sind Patient:innen, die mittels CT Angiographie untersucht werden sollten. Patient:innen mit Niereninsuffizienz, Diabetiker:innen, Patient:innen mit Schilddrüsenüberfunktion oder Patient:innen mit Jodallergie sollten dagegen im MR untersucht werden.
Darüberhinaus kann die Fragestellung für die Entscheidung MR oder CT entscheidend sein. Fragestellungen der Aorta werden primär im CT untersucht, Becken-Bein-Arterien primär im MR. Die Entscheidung kann aber auch Fall für Fall individuell zu treffen sein.
Nieren PTA/Stent
Indikationen
Der Bluthochdruck kann die Folge einer Verengung der Nierenarterien mit Minderdurchblutung einer Niere sein. Bei jungen Patient:innen, bei sich rasch entwickelndem Hochdruck und wenn der Blutdruck trotz Einnahme von Blutdruck senkenden Medikamenten nicht auf Normalwerte fällt, sollte nach einer Nierenarterien-Stenose geforscht werden. Ebenso besteht der Verdacht auf eine Nierenarterien-Stenose, wenn sich die Nierenfunktion unter Hochdrucktherapie mit ACE-Hemmern verschlechtert.
Primäre Untersuchungen zur Abklärung einer Nierenarterien-Stenose sind:
- Captopril Szintigraphie
- Computertomographie Angiographie (CTA)
- Magnetresonanz Angiographie (MRA)
- Farb-Doppler Ultraschall
Eine Kombination von Bluthochdruck und fortschreitendem Nierenversagen kann eine beidseitige Nierenarterien-Stenose zur Ursache haben.
Technik
Die PTA/Stent Behandlung der Nierenarterien-Stenose erfordert eine stationäre Aufnahme für 3–4 Tage. Am Tag der Aufnahme werden Blutbefunde erhoben (Blutbild, Blutgerinnung, Nierenfunktion, Blutfette, Blutzucker etc.).
Der Eingriff erfolgt über die Leistenarterie in lokaler Betäubung. Ein dünner Ballonkatheter wird schmerzfrei in die Nierenarterie eingeführt. Der Ballon wird in der Engstelle aufgedehnt. Genügt die Dehnung nicht, so wird ein Stent (Metallgitter-Prothese) in die Nierenarterie eingesetzt. Nach erfolgreichem Eingriff wird der Katheter entfernt, und an der Punktionsstelle in der Leiste wird ein Druckverband angelegt.
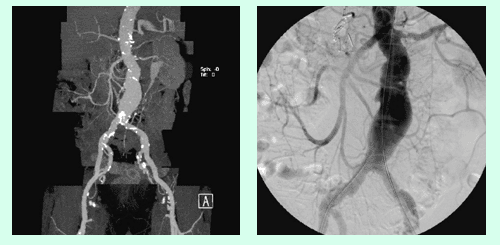
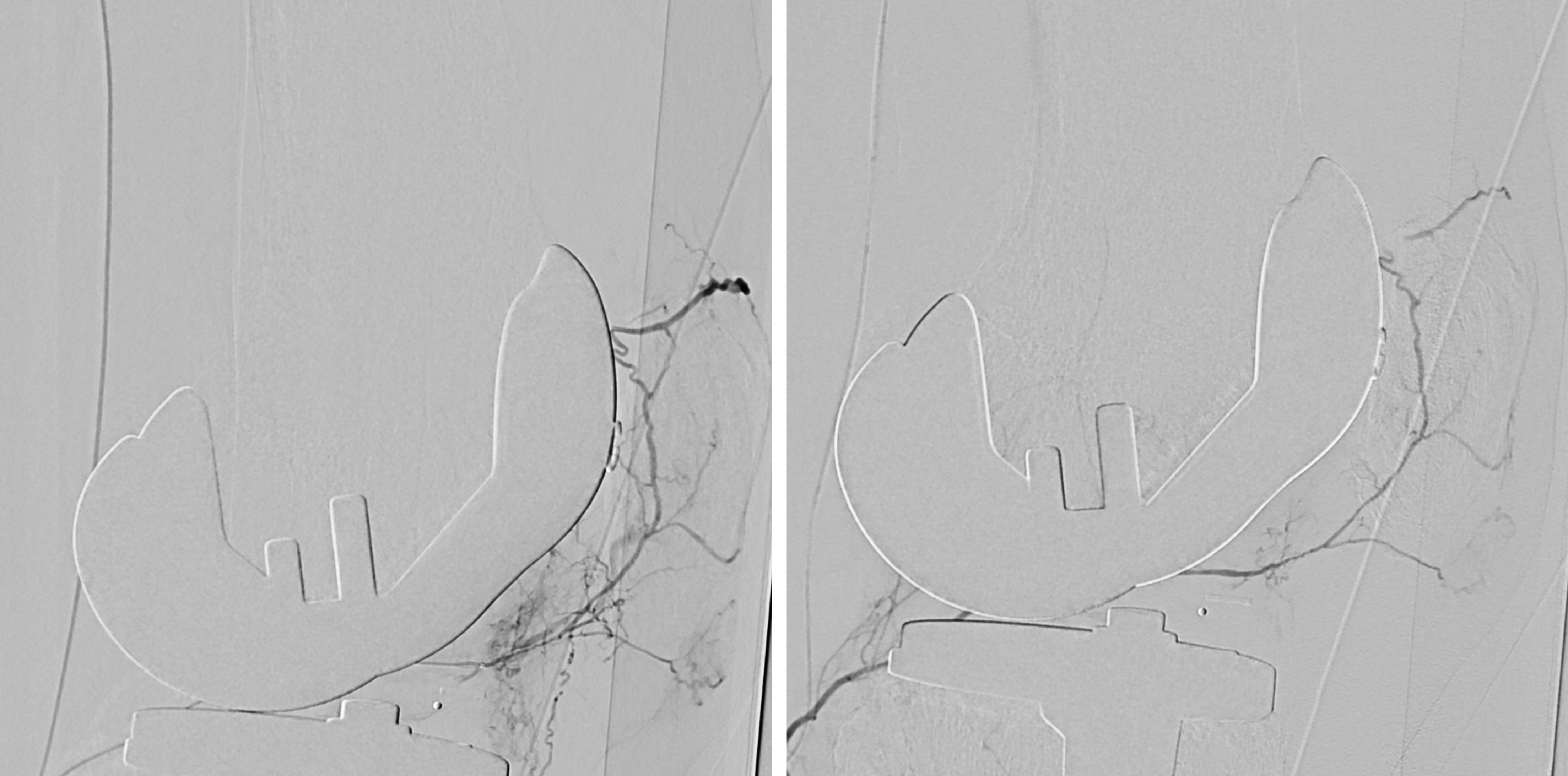
Abbildung 4a,b: Älterer Herr mit eingeschränkter Nierenfunktion, Bluthochdruck und Aortenaneurysma. CTA und Angiographie mit Nierenarterien-Stenose links.
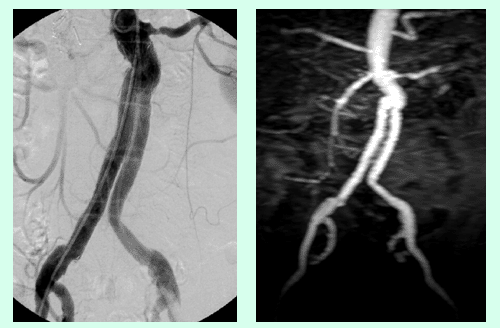
Abbildung 5a,b: Derselbe Patient wie Abb. 4. Das Aneurysma wurde mit einem Stentgraft behandelt. MRA Kontrolle des Stentgrafts mit Darstellung der Nierenarterien-Stenose links.
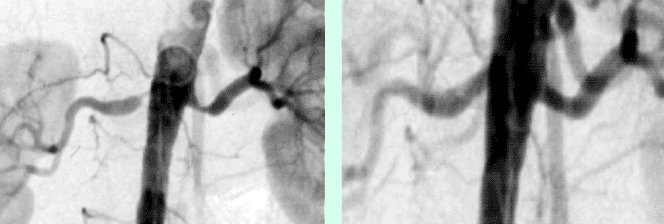
Abbildung 7a,b: Patientin mit Bluthochdruck (160/110 mmHg unter Therapie) – beidseitige Nierenarterien-Stenose – vor und nach Stent.
Vor- und Nachbehandlung
Während der PTA/Stent-Behandlung wird der:die Patient:in mit Heparin 5000 IE antikoaguliert. Nach erfolgreicher PTA wird mit Acetylsalizylsäure (ThromboAss© 100mg/d po.) und mit LMWH (Lovenox© 2x40mg/d sc. für 2d) nachbehandelt. Nach Stent-Implantation wird zuzüglich Clopidogrel (Plavix© 75mg/d po. für 4 Wochen, loading dose 4x75mg) gegeben.
Die Blutdruckmedikation muss den geänderten Verhältnissen angepasst werden.
Eine bildgebende Kontrolluntersuchung mit Duplex-US oder MRA nach PTA, mit Duplex-US oder CTA nach Stent ist nach 48 Stunden, 6, und 12 Monaten empfohlen.
Komplikationen
Die schlimmsten Komplikationen wären eine Ruptur der Nierenarterien während der PTA oder ein Verschluss infolge Dissektion. Beides wird sehr selten beobachtet (<1%). Die häufigste Komplikation ist eine Nachblutung an der Punktionsstelle in der Leiste (~5%) ev. mit nachfolgendem Pseudoaneurysma. Zur Vermeidung verwenden wir bei Risikopatient:innen Punktionsverschlusssysteme.
Andere Therapien
In erster Linie ist immer zu erwägen, ob der Bluthochdruck oder die
Nierenfunktions-Einschränkung mit medikamentöser Therapie alleine behandelt werden können.
Bei jüngeren Patient:innen sollte immer eine Dilatationsbehandlung versucht werden. Kommt es unter medikamentöser Therapie zu einer Nierenfunktions-Einschränkung, so sollte auch eine PTA/Stent-Behandlung durchgeführt werden.
Die Operation mit einem Aorto-renalen Bypass wird heute nur mehr in Ausnahmefällen durchgeführt, wenn medikamentöse Therapie und PTA versagt haben.
Indikationen
Ein Carotis Stent wird in erster Linie bei einer symptomatischen Stenose eingesetzt. Dies bedeutet eine Engstelle der Halsschlagader von >70 % und einer neurologischen Symptomatik (Arm- oder Beinschwäche, halbseitige Gefühlsstörung, Sehstörungen) innerhalb der letzten 6 Monate.
Die prophylaktische Behandlung einer asymptomatischen Stenose von >70 % steht zur Diskussion. Ein vollständiger Verschluss der Halsschlagader kann nicht behandelt werden.
Technik
In lokaler Betäubung wird die Leistenarterie punktiert. Ein dünner Katheter (ca. 2,0–2,5mm) wird in die betroffene Halsschlagader unter Röntgendurchleuchtung vorgeschoben. Die Engstelle (Stenose) wird mit einer dünnen Sonde („Führungsdraht“) sondiert. Über diese wird der Stent (Metalgitter-Prothese) über die Stenose vorgeschoben und abgesetzt. Mit einem 5–6mm Ballon wird im Stent nachgedehnt. Alle Katheter werden wieder entfernt und die Punktionsstelle in der Leistenarterie wird verschlossen.
Vor- und Nachbehandlung
Für den Carotis Stent wird man am Tag vor dem Eingriff stationär aufgenommen. Es wird die Halsschlagader mit Ultraschall angeschaut und eine MR-Untersuchung des Gehirns durchgeführt. Blut für Blutbild, Blutgerinnung, Nierenfunktion, Blutzucker und Blutfette wird abgenommen. Mittels der Medikamente Clopidogrel (Plavix© 4x75mg), Acetylsalizylsäure (ThromboAss© 100mg), und Heparin (Lovenox© 2x40mg) wird die Blutgerinnung gehemmt.
Nach dem Eingriff muss die:der Patient:in 24 Stunden im Bett liegen bleiben. Am nächsten Tag wird ein Ultraschall der Halsschlagader durchgeführt. 1–2 Tage später wird die Gehirndurchblutung mit MR kontrolliert. Die weitere medikamentöse Behandlung erfolgt mit Plavix© 75mg/d (für 4 Wochen), ThromboAss© 100mg/d, und Lovenox© 2x40mg/d sc. für 2 Tage.
Komplikationen
Das Risiko einer Embolie von der Carotis Stenose in den Gehirnkreislauf mit nachfolgenden Ausfallserscheinungen sollte bei einer symptomatischen Stenose unter 6%, bei asymptomatischen Stenosen unter 3% betragen. Der Einsatz von Filtersystemen in der Arterie hilft, diese Komplikationen weiter zu minimieren.
Eine seltene Komplikation ist ein „Hyperperfusions Syndrom“ infolge der gesteigerten Durchblutung nach dem Stent-Einsatz. Dies könnte zu einer Gehirnblutung führen.
An der Leistenpunktionsstelle kann eine Nachblutung entstehen (<5%).
Andere Therapien
Die Carotis Stenose stellt ein erhöhtes Risiko für einen Schlaganfall dar. Als Prophylaxe ist die Einnahme von gerinnungshemmenden Medikamenten wie ThromboAss© oder Plavix© sinnvoll. Die chirurgische Therapie ist die Thrombendarterektomie (TEA), eine offene Ausschälung des Gefäßes. Die Operation wird zumeist in Narkose durchgeführt. Komplikationen wie Schlaganfall sollten ebenfalls unter 6% liegen. Nervenläsionen am Hals sind zumeist temporär (<5%).
Interventionelle Onkologie
Definition:
Die Interventionelle Onkologie fasst Verfahren in der Behandlung von bösartigen Tumoren zusammen, die einerseits bildgesteuert sind, das heißt, dass der Eingriff mit Ultraschall, Computertomographie, Magnetresonanztomographie oder Röntgendurchleuchtung kontrolliert und verfolgt werden kann und die andererseits auch minimal-invasiv sind, das heißt, dass diese Verfahren durch die Einbringung von Kanülen entweder in Form von dünnen Nadeln entweder direkt durch die Haut oder in Form von dünnen Kathetern durch die Blutgefäße durchgeführt werden können.
Dementsprechend muss in den meisten Fällen keine Vollnarkose, sondern nur eine leichte Sedierung (Sedoanalgesie) vorgenommen werden.
Die minimal-invasive Tumorbehandlung hat in der letzten Zeit durch die Einführung neuer Substanzen und technischer Mittel wesentliche Fortschritte gemacht und steht heutzutage als eigenständige Säule neben der chirurgischen (Operation), der internistischen (Chemotherapie) und der strahlentherapeutischen (Bestrahlung) zur Verfügung.
In vielen Fällen werden interventionell-onkologische Verfahren zusätzlich zu einer konventionellen (chirurgischen oder internistischen) Therapie ausgeführt, um deren Wirkung zu verstärken. In manchen Fällen können interventionell-onkologische Verfahren angewendet werden, wenn eine chirurgische oder chemotherapeutische Behandlung nicht möglich ist oder nicht mehr angesprochen hat.
Im Folgenden werden die wichtigsten an unserer Klinik angebotenen Verfahren der Interventionellen Onkologie kurz vorgestellt.
1. Chemoembolisation
Bei der Chemoembolisation werden durch einen in die Arterie eingebrachten Katheter jene Arterienäste verschlossen, die den Tumor mit Blut versorgen. Der Verschluß geschieht zumeist durch die Einspritzung eines Gemisches aus einem Chemotherapeutikum mit Öltröpfchen. Auf diese Weise wird einerseits die Blut- und somit die Sauerstoffversorgung des Tumors unterbunden, und andererseits gelingt es so, eine wesentlich höhere Dosis an Chemotherapeutikum in den Tumor zu bringen, als dies durch eine konventionelle Chemotherapie mit Infusion in die Vene möglich wäre.
Eine Weiterentwicklung der Chemoembolisation gelang durch die Herstellung spezieller kleiner Kunststoffpartikel mit 0,3 bis 0,7 mm Durchmesser, die an ihrer Oberfläche mit dem Chemotherapeutikum beschichtet werden und ebenfalls in den dünnen Arterienästen im Tumor stecken bleiben und dort das Chemotherapeutikum in hoher Konzentration an den Tumor abgeben. Die Abteilung für Kardiovaskuläre und Interventionelle Radiologie ist führend an einer europaweiten Studie beteiligt, in der der positive Effekt dieser Partikel nachgewiesen werden konnte.
Die Chemoembolisation kann insbesondere bei Tumoren oder Metastasen in der Leber angewendet werden, da die Leber zwei unabhängige Blutversorgungen aufweist (einerseits die Leberarterie, andererseits die Pfortader) und ein Verschluß der Arterie dem gesunden Lebergewebe weniger schadet, als dem Tumorgewebe.
Allerdings können auch bestimmte bösartige Veränderungen des Knochens (insbesondere schmerzhafte Skelettmetastasen), unter Umständen auch andere Tumore mit Chemoembolisation behandelt werden.
2. Radioembolisation
Alternativ zur Chemoembolisation wurden in jüngerer Zeit auch Partikel entwickelt, die in die tumorversorgenden Arterien eingespritzt werden können, und die mit einer stark radioaktiven Substanz beschichtet sind, deren Strahlung jedoch nur eine sehr kleine Reichweite besitzt und deren Aktivität nach einigen Tagen wieder abklingt.
Diese Partikel bestehen aus Kunststoff oder Glas und enthalten Yttrium-90.
Sie wurden speziell für die Behandlung bösartiger Tumore oder Absiedelungen der Leber konzipiert.
In Zusammenarbeit mit der Universitätsklinik für Nuklearmedizin bietet die Abteilung für Kardiovaskuläre und Interventionelle Radiologie dieses Verfahren seit 2007 an. Bei einer Behandlung mit diesen Partikeln kann im Tumor eine äußerst hohe und stark wirksame Strahlendosis erzielt werden, während das übrige Gewebe und der gesamte Körper nur einer sehr geringen Strahlendosis ausgesetzt werden.
Dieses Verfahren erfordert einige vorbereitende Untersuchungen, in denen sichergestellt wird, dass die Arterien, für die die Behandlung geplant ist, tatsächlich nur das Tumorgewebe versorgen, um eine fehlerhafte Verteilung der Partikel und die Schädigung von anderen Organen wie etwa der Bauchspeicheldrüse oder der Lunge oder des Magens auszuschließen.
Angewendet wird die Radioembolisation bei Tumorerkrankungen der Leber, wenn die Erkrankung ausschließlich oder fast ausschließlich auf die Leber beschränkt ist.
3. Thermoablation
Unter Thermoablation wird eine Reihe von Verfahren zusammengefasst, denen gemeinsam ist, dass durch das Einstechen einer nadelförmigen Antenne durch die Haut in den Tumor der Leber, der Lunge, der Niere, des Knochens oder anderer Organe mit Hilfe von elektrischer Energie in einem 5–7 cm großen Areal eine derartige Hitze erzeugt wird, dass die dort befindlichen (Tumor-)Zellen absterben.
Je nach Verfahren handelt es sich bei der angewendeten Energie um Radiofrequenz, Mikrowellen oder sehr starke Stromimpulse.
Die Methoden der Thermoablation sind überall dort anwendbar, wo der Tumor kleiner als 5–7 cm ist und eine begrenzte Zahl von einzelnen Tumoren in dieser Größe vorliegt.
Zusätzlich dürfen im Bereich des Tumors, der behandelt werden soll, keine Organe liegen, bei denen die Wärme gefährliche Schäden auslöst (z.B. Darm, Herz, Gallengänge). In den äußeren Bezirken der Lunge, der Leber, der Niere und anderer Organe kann dieses Verfahren jedoch mit sehr geringem Komplikationsrisiko angewendet werden.
Die Verfahren der Thermoablation werden auch oft als Ergänzung zu Operationen angewendet, etwa in Fällen, wo ein großer Lebertumor in einem Leberlappen chirurgisch entfernt wird und ein kleinerer Tumor im nicht entfernten anderen Leberlappen verbleiben würde. Hier kann mittels Thermoablation auch der restliche Tumor in bestimmten Fällen ausgeschaltet werden.
Interdisziplinäre Besprechungen
Die erfolgreiche Anwendung der Methoden der Interventionellen Onkologie erfordert eine enge Zusammenarbeit verschiedener Spezialist:innen. Die Abteilung für Kardiovaskuläre und Interventionelle Radiologie stellt Spezialist:innen für wöchentliche Besprechungen, in denen zusammen mit Chirurg:innen, Onkolog:innen, Strahlentherapeut:innen, Spezialist:innen für das betroffene Organ und Radiolog:innen ein optimaler Therapieplan für Tumorpatient:innen erstellt wird und Therapiemöglichkeiten aus unterschiedlichen Fachgebieten gleichzeitig und optimiert zur Anwendung kommen können.
Leber-Tumorembolisation
Tumorembolisation
Tumore der Leber werden oft durch eine besonders kräftige Blutversorgung ernährt, welche sich im Laufe der Erkrankung ausgebildet hat, und können dadurch weiterwachsen. Ziel der sogenannten „Tumorembolisation“ ist es, diese Blutversorgung zu unterbinden, damit dem Tumor die Nahrungsquelle entzogen wird. Ohne Blutversorgung wird der Tumor nekrotisch, das heißt, er stirbt ab oder wird kleiner. Der Tumor kann durch die Leberembolisation zwar nicht entfernt werden, wird aber so unschädlich wie möglich gemacht, oder zumindest in seinem Wachstum gestoppt.
Lebertumore und Embolisation
Nicht alle Lebertumore sind für diese Art der Behandlung geeignet. Kleinere Tumore können operativ entfernt werden, je nach Lage und Größe können sie auch mit anderen Methoden wie Alkoholinstillation, Laser- oder Radiofrequenzablation behandelt werden. Mittels Tumorembolisation werden vor allem große Tumore behandelt, die eine starke Blutversorgung aufweisen.
Vorbereitungsuntersuchungen
Vor der Tumorembolisation müssen die Ausdehnung des Tumors und seine Lage genau bestimmt werden. Dies geschieht mittels einer CT-Untersuchung. Danach kann entschieden werden, welche Therapie für den Tumor am geeignetsten ist. Weiters müssen auch die Leberfunktion und die gesamte Butversorgung der Leber untersucht werden: Grundsätzlich wird die Leber durch 2 Blutsysteme versorgt: das arterielle Blutsystem und das portalvenöse Blutsystem. Während das arterielle Blutsystem zum Großteil jenes ist, das auch die Tumore versorgt, ist das portalvenöse Blutsystem hauptsächlich für den Eigenbedarf an Blut für die gesunden Leberabschnitte verantwortlich. Wichtig ist daher, daß eine genügende Blutversorgung für die Eigenfunktion der Leber erhalten bleibt, also der portalvenöse Blutfluss gesichert ist. Auch dies kann schon vor der eigentlichen Therapie im CT überprüft werden.
Technik
Ist der Tumor für die Embolisation geeignet, und die Leberfunktion gesichert, geschieht der Eingriff an der Abteilung für Kardiovaskuläre und Interventionellen Radiologie. Eine kleine Punktionsstelle in der Leiste reicht, um einen Katheter so einzuführen, dass seine Ende genau vor dem Lebertumor platziert werden kann. Die genaue Platzierung geschieht mit sogenannten Mikrokathetern, welche bis in die kleinsten Gefäße, in sogenannter „superselektiver Technik“, geführt werden können. Dies ist für den Erfolg der Behandlung besonders wichtig. Dann werden von dieser „Abschußrampe“ kleinste Kugeln, sogenannte Partikel, in einer Größe von 300–900μ in die zum Tumor führenden arteriellen Gefäße eingeschwemmt, bis sie diese völlig blockieren und ausfüllen. Danach wird ein geringe Menge „Glubran“, ein Gewebeklebstoff eingebracht, der bewirken soll, daß die Verstopfung der Tumorgefäße auch erhalten bleibt. Mittels moderner angiographischer Techniken kann der Erfolg der Behandlung sofort kontrolliert und bewertet werden. Falls mehrere arterielle Äste zum Tumor führen, können diese alle einzeln, superselektiv, mit den Mikrokathetern erfasst und behandelt werden.
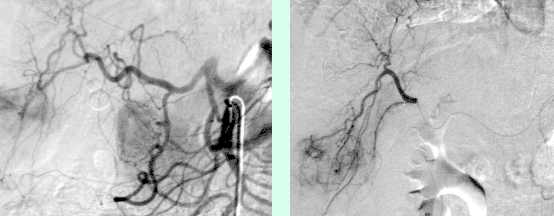
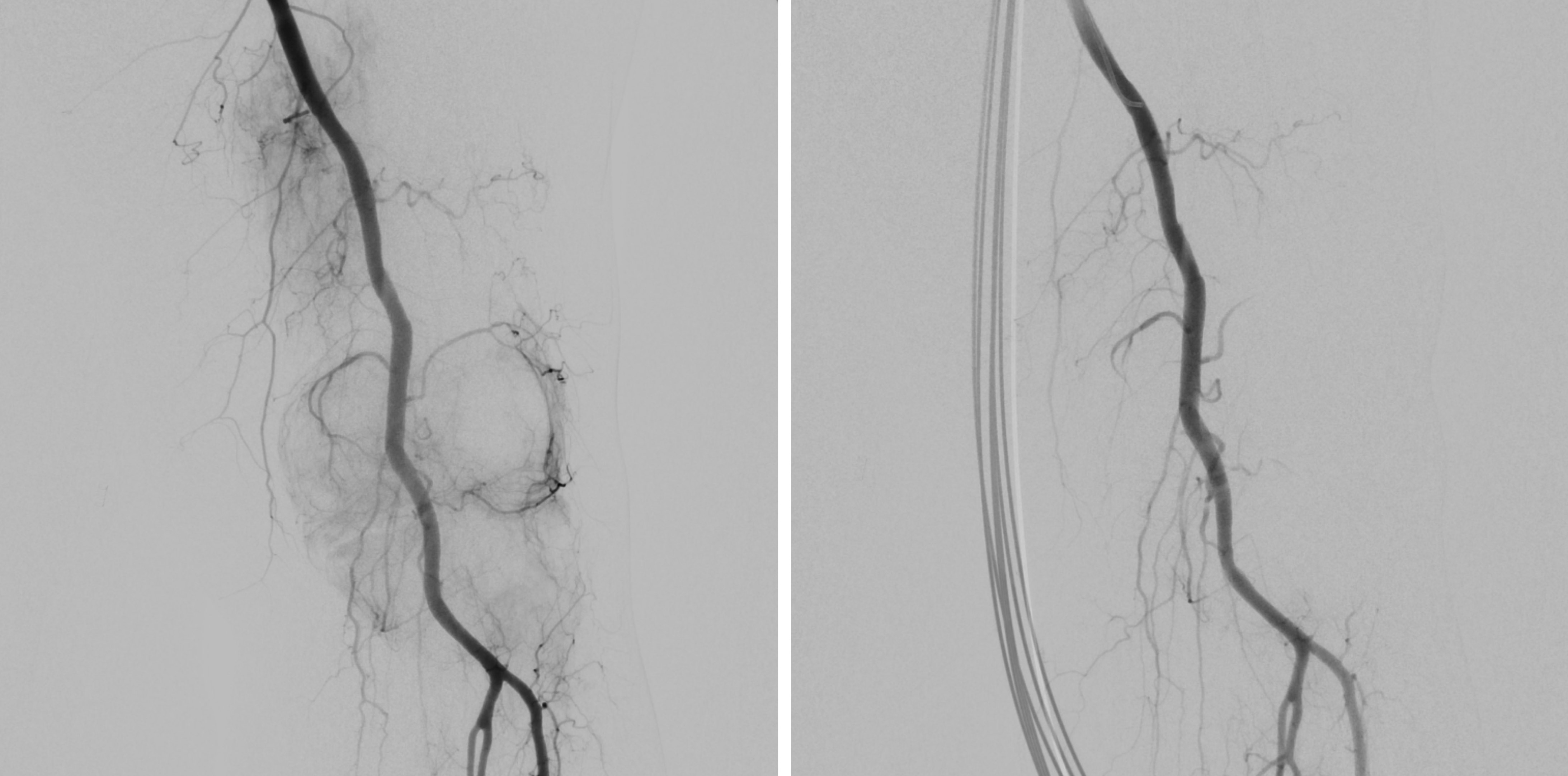
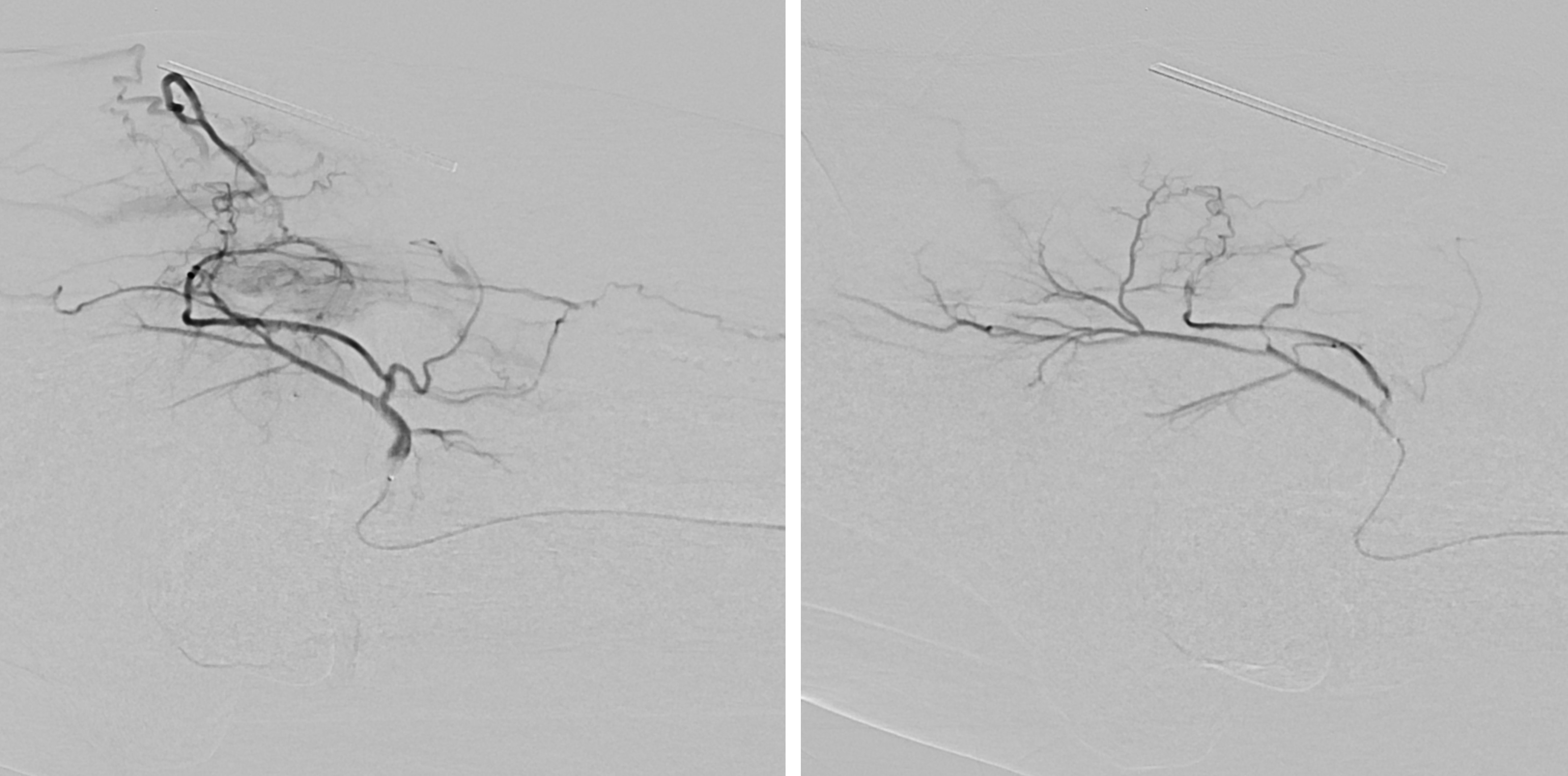
Abbildung 1: Übersichtsangiographie der Leber und superselektive Lage des Mikrokatheters vor Embolisation.
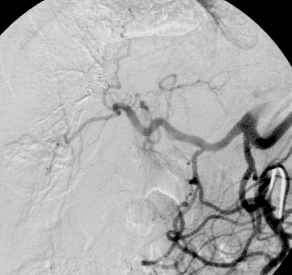
Abbildung 2: Angiographiekontrolle nach Embolisation. Die Tumor versorgenden Gefäße sind verschlossen.
Die Punktion an der Leiste erfolgt in Lokalanästhesie, während des Eingriffes können Brechreiz, Übelkeit und Schmerzen auftreten. Die Patient:innen werden daher mit einer Sedoanalgesie behandelt und erhalten auch eine Infusion gegen Übelkeit, sowie einen antiobiotischen Schutz.
Würde bei der Embolisation die gesamte Durchblutung auf einmal blockiert werden, müßte man auch mit einer Schädigung der gesunden Anteile, und mit einer Funktionsminderung der Leber rechnen. Die Behandlung wird daher meistens in 2 bis 3 Etappen durchgeführt, um den gesunden Leberanteilen eine Möglichkeit zur Erholung und Regeneration zu geben. Die exakte Planung und interdisziplinäre Durchführung unter Berücksichtigung der Gesamtsituation der Patient:innen ist besonders wichtig.
Postembolisations-Syndrom
Während der ersten Stunden bis zu 2 Tage nach dem Eingriff kann ein sogenanntes „Postembolisationssyndrom“ auftreten, welches vor allem durch Übelkeit, Fieber und eventuelle Schmerzen gekennzeichnet ist. Bei entsprechender Vorbereitung, wie sie in unserem Zentrum durchgeführt wird, sind dies Nacherscheinungen jedoch deutlich geringer, und können, falls sie auftreten, auch durch Medikamente behandelt werden.
Die Patient:innen verbleiben daher noch einige Tage nach der Behandlung im Krankenhaus, können dann aber entlassen werden. Nach etwa 5–6 Wochen sollte eine CT-Kontrolle durchgeführt werden, welche den Behandlungserfolg zeigt.
Literatur
Loewe C, Cejna M, Schoder M, Thurnher MM, Lammer J, Thurnher SA.
Arterial embolization of unresectable hepatocellular carcinoma with use of cyanoacrylate and lipiodol. J Vasc Interv Radiol. 2002 Jan;13(1):61-9
Radiofrequenz-Ablation
Allgemeine Information
Die Radiofrequenz-Ablation ist eine minimal-invasive Behandlungsmethode, welche mittels hochfrequentem elektrischen Strom in einem umschriebenen Areal hohe Temperaturen (bis 100 Grad Celsius) erzeugt und somit Gewebe zerstört. Dabei wird eine spezielle Nadel in den Tumor eingebracht, wobei die genaue Positionierung der Nadel mittels CT, MRT oder Ultraschall Bildgebung erfolgt. Anschließend wird in der Nadelspitze über einen gewissen Zeitraum, abhängig von der Größe des Tumors (typischerweise 15-20 Minuten), Hitze erzeugt, sodass der Tumor selbst und ein schmaler umgebender Sicherheitssaum zerstört werden.
Bei welchen Tumoren kann die Radiofrequenz-Ablation angewandt werden?
Leberzellkrebs (HCC-hepatozelluläres Karzinom): Die primäre Therapie des Leberzellkarzinoms ist die operative Resektion oder die Transplantation. Bei Tumoren bis 5 cm Durchmesser und bei maximal 5 Tumoren in der Leber kann die Radiofrequenz Ablation in Betracht gezogen werden, sollte die Operation nicht indiziert sein.
Lebermetastasen (Absiedelungen von Krebszellen z.B. aus dem Dickdarm): Patient:innen, bei denen eine Operation nicht sinnvoll oder möglich ist, können ebenfalls mittels Radiofrequenzablation behandelt werden, sofern die Tumore eine gewisse Größe (5cm) und Anzahl (5) nicht überschreiten.
Weiters kann die Methode bei Tumoren in der Lunge und der Niere verwendet werden, wobei hier die Indikationen erst anhand relativ kleiner Fallzahlen evaluiert wurden.
Als palliative Maßnahme bei großen Knochentumoren mit schmerzhafter Kompression umgebender Strukturen kommt die Radiofrequenz-Ablation ebenfalls zum Einsatz, da die Verkleinerung der Tumorvolumens zumeist auch eine Linderung der Schmerzen mit sich bringt.
Bei der Behandlung gutartiger Knochentumore (Osteiod-Osteome) hat die Radiofrequenz-Ablation die primäre chirurgische Therapie weitgehend abgelöst.
Wie wird die Radiofrequenzablation durchgeführt?
Nach interdisziplinärer Indikationsstellung mit den behandelnden Kollegen aus den Abteilungen für Chirurgie, Innere Medizin, Orthopädie oder Urologie erfolgt die stationäre Aufnahme. Der Eingriff selbst wird in der Abteilung für interventionelle Radiologie, je nach Lokalisation und Größe des Tumors, entweder in Vollnarkose oder in Sedoanalgesie (d.h. nach Verabreichung eines starken Schmerzmittels und eines Schlafmittels in einer Art Dämmerzustand) durchgeführt. Über einen perkutanen (= Stich durch die Haut) Zugangsweg wird dabei die Nadel vom interventionellen Radiologen unter Kontrolle durch die entsprechende Bildgebungsmodalität (CT, MRT, Ultraschall) im Tumor platziert. Sodann wird die Nadelspitze für ca. 15–20 Minuten, je nach Größe und Lokalisation des Tumors, erhitzt. Die gesamte Behandlung dauert ca. 60–90 Minuten. Üblicherweise ist anschließend lediglich ein Krankenhausaufenthalt von ca. 1–2 Tagen zur Schmerztherapie bzw. zum Ausschluss von Komplikationen notwendig.
Welche Komplikationen können auftreten?
Prinzipiell ist die Radiofrequenz-Ablation eine sehr sichere und erprobte Methode. Es kann jedoch im Rahmen der Behandlung, wie bei jedem chirurgischen Eingriff, zu Komplikationen kommen die unter Umständen eine Operation notwendig machen (z.B. Blutung, Verletzung umgebender Organe). Die genauen Risiken werden im Rahmen eines individuellen Aufklärungsgesprächs ausführlich erläutert.
Was ist der Vorteil der Radiofrequenzablation?
Im Vergleich zur operativen Behandlung ist die Radiofrequenz-Ablation für den Körper deutlich schonender (minmal invasives Verfahren) mit entsprechend geringerer Morbidität und Mortalität, wobei die Risiken immer von der Art, Lokalisation und Größe des zu behandelnden Tumors und etwaigen zusätzlichen Erkrankungen abhängig sind.
Wie kontaktieren Sie uns?
Um zu beurteilen, ob eine Radiofreqenzablation bei Ihnen möglich und sinnvoll ist, benötigen wir folgende Unterlagen:
- eine ausführliche Krankengeschichte von Ihrem behandelndem Arzt
- sämtliche bildgebende Untersuchungen
- einen Überweisungschein
Diese können Sie entweder persönlich vorbeibringen oder per Post an folgende Adresse schicken:
Universitätsklinik für Radiologie und Nuklearmedizin
Klinische Abteilung für Kardiovaskuläre und Interventionelle Radiologie
Medizinische Universität Wien/AKH Wien
Leitstelle 8F
Währinger Gürtel 18-20
1090-Wien
Tel.: +43 (0)1 40400-58020
Fax: +43 (0)1 40400-58300
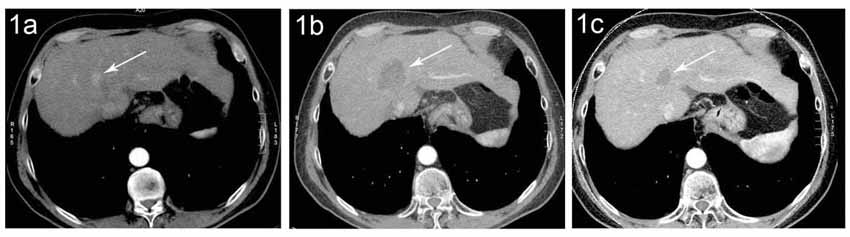
Abbildung (1a) CT eines kleinen HCC (Pfeil) bei einem Patienten mit Leberzirrhose (1b) In der Verlaufskontrolle 6 Monate nach Radiofrequenzablation zeigt sich ein nekrotisches Areal (Pfeil) ohne Hinweis auf Resttumor im Bereich des ehemaligen HCC. (1c) 4 Jahre später ist das Nekroseareal (Pfeil) deutlich kleiner. Ein Rezidiv-Tumor ist weiterhin nicht vorhanden.
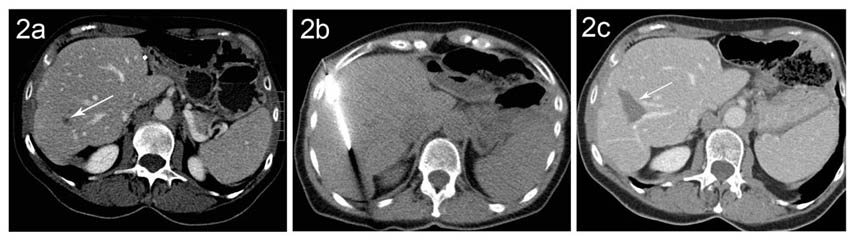
Abbildung (2a) CT einer Patientin mit einer einzelnen kleinen kolorektalen Rezidiv-Lebermetastase im rechten Leberlappen (Pfeil). (2b) CT-gezielte Platzierung der Radiofrequenznadel mit der Spitze im Bereich der Metastase (2c) In der Verlaufskontrolle zeigt sich der Behandlungserfolg mit einem Nekroseareal (Pfeil) im Bereich der Metastase ohne Hinweis auf einen Resttumor.
TIPS (Transjuguläre Intrahepatischer Portosystemischer Shunt) zur Behandlung der portalen Hypertension
Leberzirrhose
Die Leberzirrhose, auch als Schrumpfleber bezeichnet, ist das Ergebnis verschiedenster Leberschädigungen. Die häufigste Ursache in den Industrieländern ist die Schädigung durch Alkohol, gefolgt von Virushepatitiden (Gelbsucht) vom Typ B und C, erblichen Stoffwechselerkrankungen und seltener durch Autoimmunerkrankungen.
Das absterbende Lebergewebe wird durch Bindegewebe ersetzt, die Leber vernarbt, und so entsteht eine Leberzirrhose. Durch den Umbau der Leber werden auch die Blutgefäße verengt, die durch das Organ führen. Es kann nicht mehr die notwendige Menge Blut durch die Leber hindurch zum Herzen fließen. Das Blut staut sich auf der Zuflussseite in der Pfortader. Dort entsteht dadurch ein Überdruck. Diese Erscheinung nennt man Pfortaderhochdruck oder portale Hypertension.
Zu den problematischen Komplikationen zählen Bauchwasser (Aszites), Blutungen aus Krampfadern der Speiseröhre und die hepatische Enzephalopathie.
TIPS
Der transjuguläre intrahepatische portosystemische Shunt (TIPS) ist eine Methode, mit der ein Überdruck in der zur Leber führenden Pfortader durch Anlage einer „Umleitung“ in der Leber abgebaut werden kann. So erreicht man, dass die zum Teil das Leben bedrohenden Gefahren verringert werden, die mit diesem Blutstau verbunden sind. In manchen Fällen ist der TIPS nur eine kurzfristige Übergangslösung, manchmal kann er aber auch die Zeit bis zur Notwendigkeit einer Lebertransplantation um Jahre verlängern.
Technik
Der:die Patient:in erhält zunächst ein Schmerz- und Beruhigungsmittel, unter Umständen ist auch eine Vollnarkose möglich. Nun wird ein Katheter an der rechten Seite des Halses in eine Vene eingeführt und weiter in Richtung Leber geschoben. Dieser Katheter dient zum Einführen aller notwendigen Geräte für die Anlage des TIPS. Von der rechten Lebervene aus wird innerhalb der Leber (intrahepatisch) mit einer Punktionsnadel eine Verbindung zur Pfortader gestochen. An einem eingelegten Führungsdraht entlang wird dann diese Öffnung mit einem Ballon geweitet und dann eine Metallgeflechtprothese (Stent) eingeschoben. Diese Röhre aus Metallmaschen soll den neu geschaffenen Abfluss offen halten. Nun wird mehrmals der Druck im Pfortadersystem gemessen. Das Ziel ist einen Shunt mit einem Durchmesser zu erzielen, bei dem genau die für den:die Patient:in richtige Blutmenge durch den Shunt abfließt, bei der kein Stau mehr entsteht, aber auch noch möglichst viel Blut durch die Leber fließen und dort entgiftet werden kann.
Ist ein TIPS eingesetzt, so kann es vorkommen, dass sich mit der Zeit die Durchblutung wieder verschlechtert. In solchen Fällen muss eine Neueinstellung des TIPS vorgenommen werden. Ist der Leberumgehungskreislauf zu klein, besteht weiterhin die Gefahr von Blutungen aus den Krampfadern der Speiseröhre. Eine „Stentverkleinerung“ ergibt sich im Krankheitsverlauf häufig durch zunehmendes Gewebswachstum in oder an den Rändern des Stents, weshalb regelmäßige Kontrollen im Rahmen der Nachsorge äußerst wichtig sind! Gegebenenfalls ist eine erneute angiographische Untersuchung mit Aufdehnung des Stents notwendig.
An unserer Abteilung steht seit kurzem eine neue Art von Stent zur Verfügung, der fast komplett von einer PTFE (Goretex) Membran umgeben ist. Diese Kunststoffmembran verhindert ein Gewebswachstum in den Stent und somit eine Verengung.
Nebenwirkung
Eine der wichtigsten Nebenwirkungen ist das Neuauftreten oder die Verschlechterung einer hepatischen Enzephalopathie. Dies ist eine Funktionsverschlechterung des Gehirns durch giftige Stoffe im Blut (Ammoniak, entsteht durch eiweissreiche Kost). Im normalen Stoffwechsel werden diese Stoffe von der Leber aus dem Kreislauf entfernt. Der TIPS führt nun aber gerade dazu, dass ein erheblicher Teil des Blutes nicht mehr durch die Leber fließt, sondern umgeleitet wird. Die Entgiftungsfunktion wird dadurch verschlechtert. Anzeichen einer hepatischen Enzephalopathie sind Störungen in Bewegungs-, Konzentrations- und Denkvermögen.
Indikationen
- Akute Varizenblutung: wenn durch endoskopische und medikamentöse Maßnahmen (Terlipressin,Somatostatin) keine Blutstillung erreicht werden kann.
- Prophylaxe einer Erstblutung aus Ösophagusvarizen: Standardtherapie ß-Blocker (z. B.Propranolol) und Nitrate. TIPS ist bezüglich eines prophylaktischen Nutzens noch nicht geprüft.
- Sekundärprophylaxe von Ösophagusvarizenblutungen (nach Erstblutung): TIPS praktisch gleich gut wie endoskopische Therapie (Sklerosierung, Ligatur). (Rössle M. et al Lancet 1997)
- Therapierefraktärer Aszites: erwiesener Nutzen in Fällen, in denen nach Parazentese Aszites rasch nachläuft (Ochs A. et al. NEJM 1995; 332: 1192-1197). Bei schlechter Leberfunktion kann alternativ die Anlage eines Denver Shunts (peritoneovenöser Shunt) diskutiert werden.
- Budd-Chiari-Syndrom: Eine TIPS-Anlage kann die Stauung der Leber und des Darms wirksam behandeln.
- Pfortaderthrombose: Die akute Pfortaderthrombose kann durch lokale Lyse und evtl. eine TIPS-Anlage wirksam behandelt werden. Voraussetzung ist die Offenheit der zuführenden Mesenterialvenen, damit nach der Wiedereröffnung des Lumens ein genügender Blutfluß zustande kommen kann.
- Volumenhochdruck bei exzessiver Splenomegalie: Dies ist eine seltene Indikation, die in Fällen in Frage kommt, in denen eine Splenektomie nicht empfehlenswert ist. Meist liegt eine gute Leberfunktion vor, so daß mit Komplikationen durch eine TIPS-induzierte Leberinsuffizienz nicht gerechnet werden muss.
Es müssen folgende Überlegungen angestellt werden, wenn die endoskopische Therapie bei einer Ösophagusvarizenblutung versagt, um die Indikation für einen TIPS in Erwägung zu ziehen:
- Beurteilung des Risikos einer Rezidivblutung ohne TIPS (abschätzbar durch endoskopische Beurteilung der Varizen: Grad 3 und 4, red spots, Fundusvarizen)
- Beurteilung des Risikos von Blutungskomplikationen wie Enzephalopathie, Leberinsuffizienz und Niereninsuffizienz (abschätzbar nach der Child-Pugh-Klassifizierung)
- Beurteilung des Risikos einer hepatischen Enzephalopathie nach TIPS (abschätzbar nach der Child-Pugh-Klassifizierung)
- Beurteilung des Risikos einer Leberinsuffizienz unter TIPS mit Ikterus und Abfall der Gerinnungswerte (abschätzbar nach der Child-Pugh-Klassifizierung und nach der Erfahrung aus früheren Episoden)
- Bei hohem Blutungsrisiko und zudem schlechter Verträglichkeit einer Blutung ist die Notwendigkeit einer sicheren Prophylaxe sehr hoch, aber das Risiko einer TIPS-Komplikation ist bei dieser Patient:innengruppe ebenfalls erhöht. Dennoch kann sie von einer TIPS-Anlage profitieren.
- Möglicherweise profitieren Blutungspatient:innen mit erhöhter Ammoniumkonzentration eher von einer endoskopischen Therapie (Ligatur, Sklerosierung) und solche, die zusätzlich einen Aszites haben, eher von einer TIPS-Anlage (Rössle, M. et al. Lancet 1997).
Kontraindikationen
Relative Kontraindikationen
- Hepatische Enzephalopathie
- Leberinsuffizienz (< 12 P Child-Pugh)
- Akute Infektion
Absolute Kontraindikationen
- Polyzystische Lebererkrankung
- Kavernöse Transformation bei Pfortaderthrombose
- Hepatopulmonale Hypertonie
- Herzinsuffizienz
- Lebertumor
- Leberversagen (<12 P Child-Pugh)
Periphere arterielle Verschlusskrankheit
Die Häufigkeit der peripheren arteriellen Verschlusskrankheit (PAVK oder auch Schaufensterkrankheit) in der Bevölkerung nimmt mit dem Alter deutlich zu, im höheren Lebensalter sind etwa 20–30% der Bevölkerung betroffen.
Die Beschwerden werden jedoch nur von einem Viertel bis zu einem Drittel der Patient:innen geäußert. Es sind verschiedene Ursachen für diese Erkrankung bekannt, mit Abstand am häufigsten ist jedoch die Arteriosklerose (95%).
Hauptrisikofaktoren für die Entstehung der Arteriosklerose in den Beinen sind das Zigarettenrauchen, sowie Zuckerkrankheit und hoher Blutdruck, weiters auch erhöhte Blutfette.
Der Schweregrad der Erkrankung wird zumeist in vier Stadien eingeteilt:
Stadium I - asymptomatische PAVK
Stadium II - Claudicatio intermittens: Gehstrecke über 200m (II A)
Gehstrecke unter 200m (II B)
Stadium III - Ruheschmerzen
Stadium IV - Nekrose, Gangrän
Bei der Therapie der peripheren arteriellen Verschlusskrankheit steht in erster Linie das Ausschalten von Risikofaktoren wie Verzicht auf das Zigarettenrauchen und Einstellung des Bluthochdrucks, eines Diabetes und Senkung der Blutfette im Vordergrund.
Ab dem Stadium II B (Gehstrecke unter 200m) sind konservative Maßnahmen (Lebensstiländerung und medikamentöse Therapie) nicht mehr ausreichend. Es sollte eine Revaskularisation angestrebt werden. Dazu stehen sowohl interventionell-radiologische als auch gefäßchirurgische Methoden zur Verfügung.
Die typische Behandlungsmethode der Interventionellen Radiologie ist die Perkutane Transluminale Angioplastie (PTA). Bei der PTA werden Engstellen oder Verschlüsse der Arterien durch Aufdehnung mit Ballonkathetern behandelt. Hier wird üblicherweise ein Zugang über eine Leistenarterie gewählt und mit verschiedenen Führungsdrähten und Kathetern am Ort der Engstelle oder des Verschlusses gedehnt.
In bestimmten Fällen (unzureichender Dehnungserfolg, maßgebliche Spaltung der Gefäßwand) wird das Einsetzen eines Stents erforderlich.
Ein Stent besteht aus einem Drahtgeflecht, das die Arterie von innen offenhalten soll.
Durch diese symptomatischen Therapien wird jedoch die Ursache der peripheren arteriellen Verschlusskrankheit bzw. der Arteriosklerose nicht behandelt, weshalb vor allem die Raucher:innenentwöhnung sowie auch andere medikamentöse Therapien ihren Stellenwert behalten.
Jede Intervention ist mit Risiken verbunden. Die wichtigsten Risiken und Komplikationen einer PTA sind:
- Bluterguss und/oder Infektion (vor allem an der Einstichstelle)
- Gefäßdissektion (Aufspaltung der Gefäßwand)
- Thromboembolie und Gefäßverschluss
- Gefäßruptur (Platzen)
- Erfolglosigkeit oder Nicht-Durchführbarkeit des Eingriffs
In den meisten Fällen können diese Komplikationen innerhalb derselben Behandlungssitzung oder in einer weiteren interventionell-radiologischen Behandlung behoben werden oder bilden sich unter konservativen Maßnahmen oder von selbst zurück. In etwa 1–2% kann eine gefäßchirurgische Versorgung einer Komplikation notwendig werden. Das Risiko eines tödlichen Zwischenfalls liegt deutlich unter 1%.
Alles in allem ist die interventionell-radiologische Therapie der PAVK jedoch als komplikations- und risikoarm zu bezeichnen.
Nach einer erfolgten Intervention ist grundsätzlich Bettruhe für 24 Stunden einzuhalten. Häufig kann mit modernen Verschlusssystemen die Punktionsstelle verklebt werden, sodaß sich die Bettruhe auf etwa 4 Stunden verkürzt.
Für den weiteren Verlauf der Erkrankung und den langfristigen Erfolg der Behandlung ist und bleibt jedoch die Ausschaltung oder zumindest Verminderung der Hauptrisikofaktoren, wie Zigarettenrauchen, erhöhter Blutzucker oder Bluthochdruck, maßgeblich.
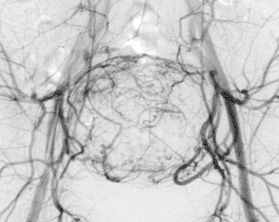
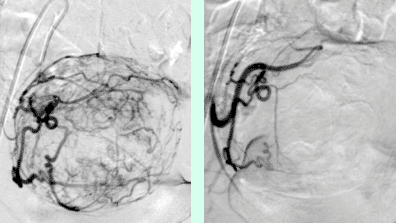
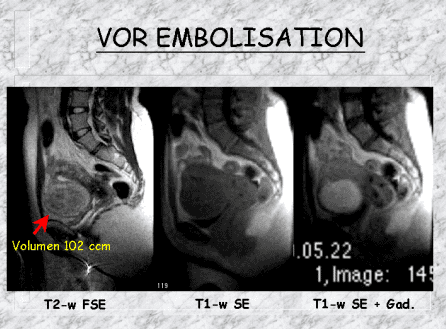
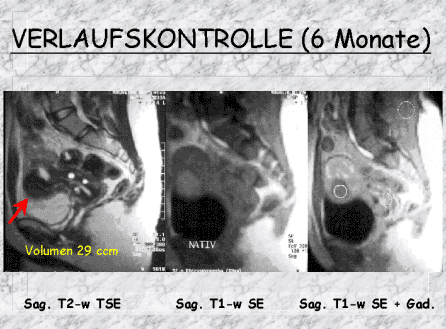
Was ist TAPE?
Die transarterielle periartikuläre Embolisation (TAPE) ist eine moderne, minimalinvasive Behandlungsmethode zur Linderung chronischer Gelenkschmerzen. Sie wird vor allem bei Arthrose und anderen entzündlichen Gelenkerkrankungen eingesetzt und bietet eine wirksame Alternative oder Ergänzung zu konventionellen Therapien.
Wie funktioniert TAPE?
Bei chronisch-entzündlichen Gelenkerkrankungen wie der Arthrose kommt es zu einer persistierenden Entzündungsreaktion im Gelenk, die mit einer verstärkten Angiogenese einhergeht. 1-4
Diese neugebildeten Blutgefäße fördern das Wachstum nozizeptiver Nervenfasern, die maßgeblich zur Schmerzsymptomatik beitragen.
TAPE nutzt einen minimalinvasiven Zugang über die Arteria femoralis oder A. radialis, um unter angiographischer Kontrolle einen Mikrokatheter selektiv in die das betroffene Gelenk versorgenden Arterien vorzuschieben. Durch die präzise Platzierung von Embolisationspartikeln (winzige Teilchen, die Blutgefäße verschließen) werden die krankhaft vermehrten Blutgefäße blockiert. Dadurch wird die Entzündungskaskade (eine Reihe von Reaktionen, die die Entzündung aufrechterhalten) unterbrochen und die Weiterleitung von Schmerzsignalen nachhaltig reduziert.
Ablauf des Eingriffs
- Die Behandlung erfolgt in der Regel unter Lokalanästhesie.
- Dauer: ca. 45–75 Minuten.
- Zugang über eine kleine Punktion in der Leiste oder am Handgelenk.
- Präzise Steuerung des Katheters unter Röntgendurchleuchtung.
- Gezielte Applikation von Embolisationspartikeln.
- Nach dem Eingriff: ca. 6 Stunden Ruhigstellung.
- Entlassung meist am Vormittag des Folgetages.
Vorteile von TAPE
- Minimalinvasiver Eingriff
- Geringes Komplikationsrisiko
- Schnelle Erholungszeit
- Anwendbar an verschiedenen Gelenken (z. B. Knie, Hüfte, Schulter)
- Schmerzreduktion und Funktionsverbesserung ohne Operation
- Wiederholbarkeit bei Bedarf
Wissenschaftliche Grundlage
Mehrere Studien haben die Wirksamkeit und Sicherheit der TAPE für verschiedene Gelenkpathologien bestätigt. Randomisierte kontrollierte Studien, insbesondere für das Kniegelenk, haben vielversprechende Ergebnisse gezeigt. Weitere Forschung zur Optimierung der Technik und Evaluierung der Langzeiteffekte ist im Gange. 5-20
Häufig gestellte Fragen (FAQ)
Für wen ist TAPE geeignet?
- Patienten mit chronischen Gelenkschmerzen, die auf andere Therapien nicht ausreichend ansprechen.
- Patienten mit mild bis moderater degenerativer Gelenkerkrankungen zur symptomatischen Behandlung chronische inflammatorischen Entzündungskomponente.
- Bei Tendinopathien (z. B. Tennisellenbogen, Patellatendinitis, Plantarfasziitis).
- Patienten mit Kontraindikationen für Operationen.
- Personen, die eine schonende, minimalinvasive Behandlung suchen.
Gibt es Nebenwirkungen?
- Komplikationen an der Punktionsstelle:
Subkutane kleine Blutungen an der Einstichstelle sind häufig, jedoch meist vorübergehend und ohne langfristige Folgen. - Pseudoaneurysma (PSA):
Ein Pseudoaneurysma(Verletzung der Gefäßwand) kann sich in seltnen Fällen an der Punktionsstelle entwickeln. Dies ist eine bekannte Komplikation bei endovaskulären Eingriffen und erfordert gegebenenfalls eine verlängerte Kompression mittels Druckverband, eine gezielte Medikamentengabe in das Pseudoaneurysma oder in sehr selten Fällen eine zusätzliche chirurgische oder interventionelle Behandlung. - Radialer Zugang – Risiko eines Arterienverschlusses:
Beim Zugang über die A. radialis (Unterarmarterie) besteht ein geringes Risiko eines Arterienverschlusses. Symptomatische Verschlüsse sind selten, da die Blutversorgung häufig durch die A. ulnaris (Zweite Unterramarterie) kompensiert wird. - Nicht-zielgerichtete Embolisation:
Kleinere Embolisationspartikel (<100 µm) können in seltenen Fällen in distale Gefäße gelangen und unbeabsichtigte Ischämien (Blutunterversorgungen) oder neurologische Symptome, wie transiente sensorische Parästhesien(Gefühlsstörungen) verursachen. Die Wahl größerer Partikel (100–300 µm) sowie die Wahl von temporären(sich auflösenden) Partikel reduziert dieses Risiko erheblich. - Weitere mögliche Komplikationen:
Gelegentliche Hautveränderungen wie temporäre Rötungen oder Verfärbungen im behandelten Bereich. (ca. 10%)
Sehr seltene allergische Reaktionen auf das Kontrastmittel
Diese Quellen zeigen, dass TAPE insgesamt ein sicheres Verfahren ist, jedoch eine sorgfältige Auswahl der Technik und Materialien entscheidend ist, um Komplikationen zu minimieren.
Kann TAPE bei implantierter TEP angewendet werden?
Ja, eine Anwendung bei einer bereits implantierten Totalendoprothese (TEP) ist möglich – jedoch nur nach sorgfältiger Abklärung möglicher Schmerzursachen. Vor einer TAPE-Behandlung sollten folgende Punkte evaluiert werdent (am Beispiel Knie TEP):
Liegt eine Infektion vor? (Abklärung nach EBJIS-Kriterien und klinischem Befund)
→ Falls ja: Behandlung der Infektion steht im Vordergrund.
Gibt es eine aseptische Lockerung? (Abklärung mittels SPECT/CT)
→ Falls ja: Orthopädische Behandlung notwendig.
Besteht eine Fehlstellung oder ein femoropopliteales Problem?
→ Falls ja: Korrektur oder Nachversorgung (z. B. Patella-Resurfacing).
Liegt eine Metallallergie oder Hypersensitivität vor?
→ Falls ja: Allergiemanagement.
Sind all diese Ursachen ausgeschlossen, kann TAPE eine schonende, symptomatische Therapieoption sein.
Kontakt
Wenn Sie an chronischen Gelenkschmerzen leiden und erfahren möchten, ob TAPE für Sie infrage kommt, kontaktieren Sie uns gerne für eine persönliche Beratung:
Medizinische Universität Wien
Universitätsklinik für Radiologie und Nuklearmedizin
Klinische Abteilung für Kardiovaskuläre und Interventionelle Radiologie-8F
- Bonnet CS, Walsh DA. Osteoarthritis, angiogenesis and inflammation. Rheumatology (Oxford). 2005 Jan;44(1):7–16.
- Ashraf S, Walsh DA. Angiogenesis in osteoarthritis. Curr Opin Rheumatol. 2008 Sep;20(5):573–80.
- Ashraf S, Mapp PI, Walsh DA. Contributions of angiogenesis to inflammation, joint damage, and pain in a rat model of osteoarthritis. Arthritis Rheum. 2011 Sep;63(9):2700–10.
- Mapp PI, Walsh DA. Mechanisms and targets of angiogenesis and nerve growth in osteoarthritis. Nat Rev Rheumatol. 2012 May;8(7):390–8.
- Bedros Taslakian, Christiana Salami, Yan Epelboym. Genicular Artery Embolization: A Practical Guide for Interventional Radiologists. Patient selection, imaging techniques, procedural insights, strategies for optimizing patient outcomes, and more.
- Taslakian B, Miller LE, Mabud TS, et al. Genicular artery embolization for treatment of knee osteoarthritis pain: systematic review and meta-analysis. Osteoarthr Cartil Open. 2023;5:100342. doi: 10.1016/j.ocarto.2023.100342
- Gorsi U, Singh D, Kang M, Kumar V, Prakash M, B C S. Safety and Efficacy of Genicular Artery Embolization for the Treatment of Knee Pain Secondary to Osteoarthritis-Initial Indian Experience. Indian J Radiol Imaging. 2024 Jan;34(1):37–43.
- O’Grady AM, Little MW. Genicular Artery Embolization Data Review. Tech Vasc Interv Radiol. 2023 Mar;26(1):100880.
- Little MW, Gibson M, Briggs J, Speirs A, Yoong P, Ariyanayagam T, et al. Genicular artEry embolizatioN in patiEnts with oSteoarthrItiS of the Knee (GENESIS) Using Permanent Microspheres: Interim Analysis. Cardiovasc Intervent Radiol. 2021 Jun;44(6):931–40.
- Fleckenstein FN, Auer TA, Hamm B, Gebauer B, Collettini F. Genicular artery embolization for the treatment of symptomatic knee OA: a comprehensive analysis of 167 patients.
- Bolsegui ML, Ghozy S, Kobeissi H, Kadirvel R, Kallmes DF, Thompson SM. Common Design, Data Elements and Core Outcome Measures Reported on Clinical Trials of Genicular Artery Embolization for Knee Osteoarthritis: An Interactive Systematic Review. Acad Radiol. 2024 Mar;31(3):977–93.
- Bhatia A, Bhatia S. The short-to-midterm outcomes of geniculate artery embolization for mild-to-moderate osteoarthritis of the knee: a systematic review. J Orthop. 2023 May;39:30–41.
- Sterbis E, Casadaban L. Genicular Artery Embolization Technique. Tech Vasc Interv Radiol. 2023 Mar;26(1):100878.
- Tyagi R, Ahmed SS, Koethe Y, Raskind A, Ahmed O. Genicular Artery Embolization for Primary Knee Osteoarthritis. Semin Intervent Radiol. 2022 Apr;39(2):125–9.
- Little MW, Gibson M, Briggs J, Speirs A, Yoong P, Ariyanayagam T, et al. Genicular artEry embolizatioN in patiEnts with oSteoarthrItiS of the Knee (GENESIS) Using Permanent Microspheres: Interim Analysis. Cardiovasc Intervent Radiol. 2021 Jun;44(6):931–40.
- Okuno Y, Korchi AM, Shinjo T, Kato S, Kaneko T. Midterm Clinical Outcomes and MR Imaging Changes after Transcatheter Arterial Embolization as a Treatment for Mild to Moderate Radiographic Knee Osteoarthritis Resistant to Conservative Treatment. J Vasc Interv Radiol. 2017 Jul;28(7):995–1002.
- van Zadelhoff TA, Okuno Y, Bos PK, Bierma-Zeinstra SMA, Krestin GP, Moelker A, et al. Association between Baseline Osteoarthritic Features on MR Imaging and Clinical Outcome after Genicular Artery Embolization for Knee Osteoarthritis. J Vasc Interv Radiol. 2021 Apr;32(4):497–503.
- Padia SA, Genshaft S, Blumstein G, Plotnik A, Kim GHJ, Gilbert SJ, et al. Genicular Artery Embolization for the Treatment of Symptomatic Knee Osteoarthritis. JB JS open access. 2021;6(4).
- Bagla S, Piechowiak R, Sajan A, Orlando J, Hartman T, Isaacson A. Multicenter Randomized Sham Controlled Study of Genicular Artery Embolization for Knee Pain Secondary to Osteoarthritis. J Vasc Interv Radiol. 2022 Jan;33(1):2-10.e2.
- Parvizi J, Adeli B, Zmistowski B, Restrepo C, Greenwald AS. Management of periprosthetic joint infection: The current knowledge - AAOS exhibit selection. Journal of Bone and Joint Surgery - Series A. 2012.
Embolisation
Technik
Die Technik der Embolisationsbehandlung ist eine altbekannte Technik in der Medizin. Sie wird seit den 60er Jahren zur Behandlung von Blutungen und Tumoren im ganzen Körper eingesetzt. Auch an der Gebärmutter wird diese Technik bereits seit langem zur Behandlung z.B. unstillbarer Blutungen nach der Geburt oder bei bösartigen Tumoren eingesetzt. Anfang der 90er Jahre hat eine Pariser Arbeitsgruppe diese Methode auch zur Behandlung der Myome weiterentwickelt. Seit 1995 wird das Verfahren vermehrt eingesetzt. Weltweit sind mehr als 10.000 Behandlungen durchgeführt worden.
Nach örtlicher Betäubung wird ein dünner Plastikschlauch in ein Blutgefäß (Femoralarterie) in der Leistengegend eingeführt und von hier aus unter Gabe von Röntgenkontrastmittel und Röntgenkontrolle bis dorthin vorgeführt, wo die Schlagader der Gebärmutter (Uterusarterie) Äste abgibt, die das Myom versorgen.
Über den Katheter werden dann Partikel eingespritzt (Größe: 0,3–0,7 mm), die sich in den in der Nähe des Myoms reichlich vorhandenen, verzweigten Blutgefäßen festsetzen und diese dauerhaft blockieren – „embolisieren“. Kommt der Blutfluss einer Seite zum Stehen, wird der Katheter aus der Gebärmutterarterie herausgezogen und unter Röntgensicht in die gegenseitige Gebärmutterarterie eingeführt und der Vorgang in gleicher Weise wiederholt. Eine Unterbrechung des Blutflusses beider Seiten ist notwendig, da sich das Myom sonst von der anderen Seite her ernähren könnte. Das Myom wird so von der Blutversorgung abgeschnitten und nicht mehr ausreichend ernährt. Es wird quasi ausgehungert und verödet.
Anschließend wird der Katheter aus dem Körper entfernt und die Zugangsstelle mit einfachem Finger-Druck verschlossen – nach dieser Zeit steht die Blutung aus der Punktionsstelle; zur Sicherheit wird noch ein Druckverband angelegt. Nach 24 Stunden kann die Patientin aufstehen und herumgehen; bis dahin ist Bettruhe einzuhalten; Essen und Trinken ist sofort wieder erlaubt.
Im Verlauf der nächsten Monate schrumpft das Myom auf etwa die Hälfte bis ein Viertel seiner Grösse (um etwa 60% innerhalb von 6 Monaten, um etwa 70% innerhalb von 12 Monaten). Dies reicht bei über 90% der Patientinnen aus, um die Beschwerden erfolgreich zu behandeln. Die Blutversorgung der Gebärmutter wird durch Nebenadern übernommen, die den Erhalt der Gebärmutter sichern, aber die Myome nicht ausreichend versorgen können.
Schmerztherapie
Da die Gebärmutter von ihrer Hauptblutversorgung abgekoppelt wird, schwillt sie an. Dies würde ohne entsprechende Behandlung zu Schmerzen, Übelkeit und Temperaturanstieg führen, dem sogenannten Postembolisationssyndrom.
Um diese Beschwerden erst gar nicht auftreten zu lassen, werden die Patientinnen vom Narkosearzt an eine sogenannte PCA Schmerzpumpe angeschlossen. Hierbei gibt die Schmerzpumpe einen kontinuierlichen Anteil schmerzstillende Medikamente ab, der bei Bedarf, d.h. aufkommenden Schmerzen, durch die Patientin selbst kurzfristig erhöht werden kann.
Nach einem Tag sind die Beschwerden so milde geworden, dass auf Schmerzmittel in Zäpfchenform umgestellt werden kann, die je nach Bedarf für 7 bis 10 Tage weiter genommen werden müssen.
Um Infektionen vorzubeugen, werden außerdem unmittelbar vor dem Eingriff Antibiotika über die Vene zugeführt; bei großen Myomen geben wir Antibiotika für eine Woche zusätzlich in Tablettenform.
Erfolgsrate
Technisch gelingt der Eingriff bei 98% der Fälle. Die Beschwerden werden bei über 90% aller Fälle erfolgreich behandelt.
Komplikationsmöglichkeiten
Postembolisationssyndrom: Die dazugehörigen Beschwerden treten in allen Fällen mehr oder minder ausgeprägt auf und zeigen die erfolgreiche Verödung an. Sie sind aber vorübergehender Natur.
Infektion: Infektionen können bei 1–2% der Fälle den Eingriff verkomplizieren. Sie werden durch die Embolisation begünstigt, da sich in nicht mehr durchblutetem Gewebe Keime eher festsetzen können. Um dies zu verhindern, erhalten die Patientinnen eine antibiotische Therapie. Tritt eine solche Infektion auf, so muß antibiotisch intensiv behandelt werden; in seltenen Fällen kommt es zur Vereiterung der Gebärmutter, so dass diese entfernt werden muß. Mit der Größe des Myoms steigt auch das Risiko, dass es zu einer Infektion kommt, an.
Sollte eine Patientin daher auf keinen Fall und unter keinen Umständen mit einer Gebärmutterentfernung einverstanden sein, sollte keine Embolisationsbehandlung durchgeführt werden, da eine, wenn auch sehr geringe Möglichkeit, zur Entfernung besteht, falls Komplikationen auftreten.
Hinweise auf eine mögliche Infektion sind ein eitriger Ausfluss aus der Scheide, starke und zunehmende Schmerzen im Unterbauch sowie ansteigendes Fieber. In all diesen Fällen sollten Sie umgehend Ihre:n Hausärzt:in oder Frauenärzt:in, in Absprache mit diesem auch den:die behandelnde:n Krankenhausärzt:in, aufsuchen!
Infektionen können auch in größerem Abstand zum Eingriff, z.B. auch nach einem Vierteljahr, noch auftreten.
Embolisatverschleppung: In der Nähe der Gebärmutterarterie entspringen die Äste zur Blase und zur Scheide. Theoretisch ist eine Verschleppung von Kunststoffpartikeln in diese Äste möglich, sodass hier Schleimhautschäden entstehen könnten. Tatsächlich tritt dies aber nur äußerst selten auf.
Ausbleiben der Regel: In den meisten Fällen nach Myomembolisation bleibt der Zyklus ungestört, auch wenn nach erfolgreicher Behandlung die Monatsblutung deutlich verringert sein sollte.
In einigen Fällen kann es zum vorübergehenden Ausbleiben der Regel kommen; in der Folge kann sich der Zyklus dann wieder regulieren.
In Ausnahmefällen (1%) kommt es zum vorzeitigen dauerhaften Ausbleiben der Regel. Dies betrifft vor allem Patientinnen, die bereits kurz vor den Wechseljahren stehen.
Ausstoßung des Myoms: In etwa 10% der Fälle – insbesondere dann, wenn das Myom unmittelbar unter der Schleimhaut zur Gebärmutterhöhle hin gelegen ist, kann das Myom innerhalb von 3 Monaten nach Behandlung nach innen abgestoßen und „geboren“ werden. Hierbei kommt es zu periodenartigen Beschwerden und blutigem Ausfluss.
Dies führt im allgemeinen nicht zu einer Komplikation, ist aber nicht immer angenehm. Nur wenn das abgestoßene Gewebe im Gebärmutterinneren verbleibt, kann dies eine Infektion begünstigen; wenn die Patientin daher das Gefühl hat, dass dies bei ihr der Fall ist, sollte sie auf jeden Fall einen Arzt aufsuchen.
Sonstige Komplikationen: Zu den sonstigen Komplikationen des Eingriffs zählen alle möglichen Komplikationen eines Kathetereingriffs wie eine Allergie gegen Kontrastmittel oder lokale Betäubungsmittel, Gefäßverletzung, Blutung oder Gefäßverschluss. Diese Komplikationen sind allerdings sehr selten. Ein Bluterguss an der Einstichstelle entsteht häufiger, ist aber in der Regel harmlos.
Nachbehandlung
Nach der Behandlung können sich die Patientinnen für eine Phase von etwa 2 Wochen etwas abgeschlagen und müde fühlen, so dass sie in dieser Zeit nicht arbeiten sollten. Ebenfalls kann nach der Behandlung ein Ausfluss auftreten, der sich innerhalb einer Woche abschwächen sollte und bis zu 2 Wochen anhalten kann. Leichte Unterbauchschmerzen – ähnlich dem Periodenschmerz – können in der ersten Woche ebenfalls noch erwartet werden.
In dieser Phase erfolgt eine Behandlung mit leichteren entzündungshemmenden Schmerzmitteln. Auf das Auftreten von Entzündungszeichen (siehe oben) ist zu achten.
Die Patientin sollte nach der Entlassung aus dem Krankenhaus auch bald ihre:n Frauenärzt:in aufsuchen, um sich weiter betreuen und beraten zu lassen.
Da bei diesem Verfahren die Gebärmutter belassen wird, sind nach einer Ausschälungsoperation Schwangerschaften weiterhin möglich. Allerdings kann es in Folge der Operation zu Verwachsungen in der Bauchhöhle kommen, die die Eileiter versperren oder Eileiterschwangerschaften Vorschub leisten können. Kommt es während der Operation zu starken Blutungen, kann im Einzelfall die Entfernung der gesamten Gebärmutter notwendig werden.
Vertebroplastie
Unter „Vertebroplastie“ versteht man sehr vereinfacht ausgedrückt das „Aufzementieren“ von Wirbelkörpern, welche eingebrochen sind und dadurch Schmerzen verursachen. Die Methode wird tatsächlich bereits seit etlichen Jahren praktiziert, und bislang sind tausende Patient:innen behandelt worden. Durch die fortlaufende Entwicklung der Instrumente und des Materials ist die Methode nun tatsächlich so gut einsetzbar, dass sie mit einer sehr hohen Erfolgsrate angewandt werden kann: wir sind nun so weit, diesen minimal invasiven Eingriff in einer Behandlungszeit von zumeist unter einer Stunde und mit einer Krankenhausaufenthaltsdauer von nur einem Tag anzubieten.
Der Wirbelkörper
Die zumeist betroffenen Wirbelkörper sind jene der Lendenwirbelsäule. Sie sind relativ groß, dennoch aber jene, die am häufigsten von schmerzhaften Einbrüchen betroffen sind. Der Wirbelkörper besteht aus dem sogenannten Corpus und zwei schmäleren Ausläufern nach hinten, den Pedikeln, welche sich zum Rücken zu schließen. Zwischen 2 aufeinanderliegenden Wirbelkörpern werden im Bereich der Pedikel jeweils links und rechts Austrittstellen für Nerven ausgespart, die Neuroforamina. Diese spielen eine Schlüsselrolle, denn wenn ein Wirbelkörper zusammenbricht, besteht auch die Gefahr einer Einengung der Neuroforamina.
Innerhalb des geschlossenen Ringes von Corpus und Pedikeln liegt der Wirbelkanal.
Im Bereich der Lendenwirbelsäule verlaufen hier lediglich Ausläufer von Nervenfasern, im Bereich der Brustwirbel und Halswirbelsäule jedoch das Rückenmark.
Wirbelkörpereinbrüche können aus verschiedenen Ursachen entstehen: Zumeist sind es sogenannte „osteopororitsche Einbrüche“, welchen eine Entkalkung und damit Schwächung der Wirbelkörper bei Osteoprose zugrunde liegt. Betroffen sind davon zumeist Frauen in und nach der Menopause. Wirbelkörperfrakturen können jedoch auch durch ein Trauma bedingt sein, oder in selteneren Fällen durch einen Tumor.
Vorbereitungsuntersuchungen
Grundlage der Behandlung ist die richtige Diagnose. Diese geschieht zunächst meist durch eine klinische Untersuchung, anschließend durch eine Röntgenuntersuchung. Hierbei reicht zunächst ein einfaches Röntgenbild. Wenn jedoch eine Behandlung geplant wird, sollte auch eine CT (Computertomographie) Untersuchung durchgeführt werden. Welcher Wirbelkörper für eine Behandlung geeignet ist kann nur die:der Expert:in beurteilen. Davon hängt auch der Erfolg der Behandlung ab. Diese Beurteilung erfolgt durch eine:n Fachärzt:in oder spezialisierten praktischen Ärzt:in, den Sie zuvor unbedingt aufsuchen sollten. Erst nachdem eine sichere Beurteilung durchgeführt worden ist, kann die Indikation zur Behandlung gestellt werden und an der Abteilung für Kardiovaskuläre und Interventionelle Radiologie durchgeführt werden.
Wenn eine gemeinsame Entscheidung zwischen Patien:innen, begutachtenden Fachärzt:innen und den Interventionellen Radiolog:innen, die den Eingriff durchführen, getroffen wurde, wird ein Termin vereinbart. Der:die Patient:in benötigt noch eine sogenannte „Interne Freigabe“, die bestätigt, dass der Eingriff von klinischer Seite durchgeführt werden kann, sowie ein aktuelles Blutbild mit einem sogenannten „Gerinnungsstatus“. Ein Aufklärungsgespräch, in dem der:die Patient:in nochmals genau informiert wird, wird am Vortag vor dem Eingriff stattfinden. Am Tag des Eingriffes muss der:die Patient:in nüchtern sein, jedoch allfällige vorgeschriebene Medikamente einnehmen.
Technik
Der Eingriff wird in Lokalanästhesie und unter sterilen Bedingungen durchgeführt. Der Raum entspricht einem kleinen OP-Raum, wobei der Operationstisch jedoch ein Computertomograph ist, der eine unmittelbare Kontrolle und Steuerung des Eingriffes ermöglicht. Der:die Patient:in liegt am Bauch. Der Eingriff geschieht vom Rücken aus.
Die Größe des Einstiches entspricht lediglich der einer Punktionsnadel. Über einen am Computer errechneten kürzesten und sichersten Weg wird die Kanüle eingebracht, und kann ständig über einen Monitor überwacht werden. Sobald die Kanüle an richtiger Position, nämlich im Wirbelkörper ist, kann der nun ebenfalls steril vorbereitete Knochenzement eingebracht werden. Auch dies geschieht wieder kontrolliert. Wenn der Zement an richtiger Stelle ist, kann die Kanüle sofort entfernt werden, und der Eingriff ist beendet. Der:die Patient:in könnte sofort wieder aufstehen, bleibt jedoch noch im Bett liegen, und wird auf sein Zimmer gebracht.
Sicherheit
Die großen technischen Apparate und der sterile OP Raum können die Patient:innen verunsichern. Durch diese Aufwendungen kann der Eingriff jedoch besonders präzise gesteuert werden, denn die Kanüle muss vorbei an den Nerven an einen bestimmten errechneten Platz im Wirbelkörper gebracht werden, welcher dann die größtmöglichste Stabilität bewirkt. Diese Kontrolle wird doppelt bewirkt – durch den Computertomographen und die Durchleuchtung. Der Eingriff sollte auch nur durchgeführt werden, wenn diese doppelte Sicherheit garantiert wird. Nur durch die genaue Steuerung können Fehler verhindert werden. Hinter all den Apparaten und den grünen Tischen und Tüchern stehen jedoch Menschen, mit denen Sie schon zuvor gesprochen haben, und mit denen Sie auch ständig während des Eingriffes kommunizieren können und die auf Ihr Befinden sofort reagieren können.
Nachbehandlung
Der:die Patient:in kann nach kurzer Liegezeit bereits wieder aufstehen, gehen und nach Belieben essen und trinken. Bei unkompliziertem Verlauf könnte der:die Patient:in bereits wieder am Abend nach einer nochmaligen Visite und Begutachtung des:der Ärzt:in nach Hause gehen. Frühzeitige Kontrollen sind nur notwendig, wenn der:die Patient:in Beschwerden verspürt. Eine CT-Untersuchung nach 6 Monaten ist empfohlen.
Adressen
Spezialkliniken, welche die Vertebroplastie in Österreich anbieten:
KH der Elisabethinen, Linz, Abteilung für Radiologie OA Dr. Gschwaendtner
AKH Wien: Klinische Abteilung für Kardiovaskuläre und Interventionelle Radiologie